M3S4_RE
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. Les électrolytes
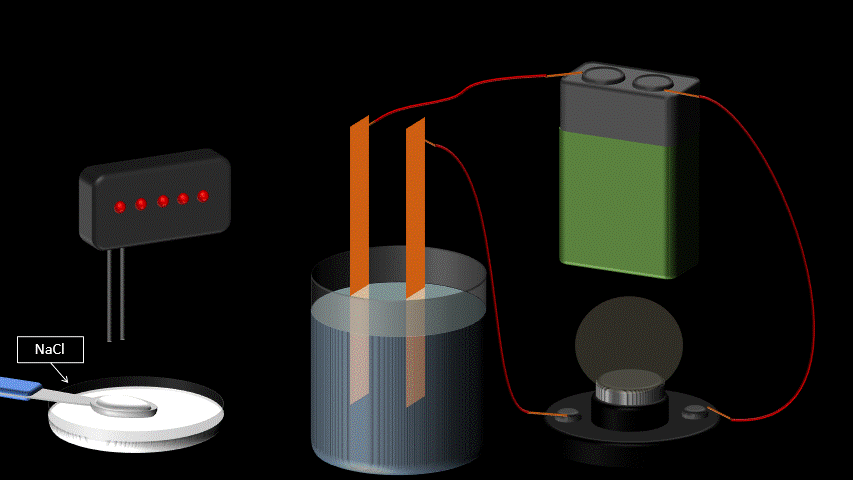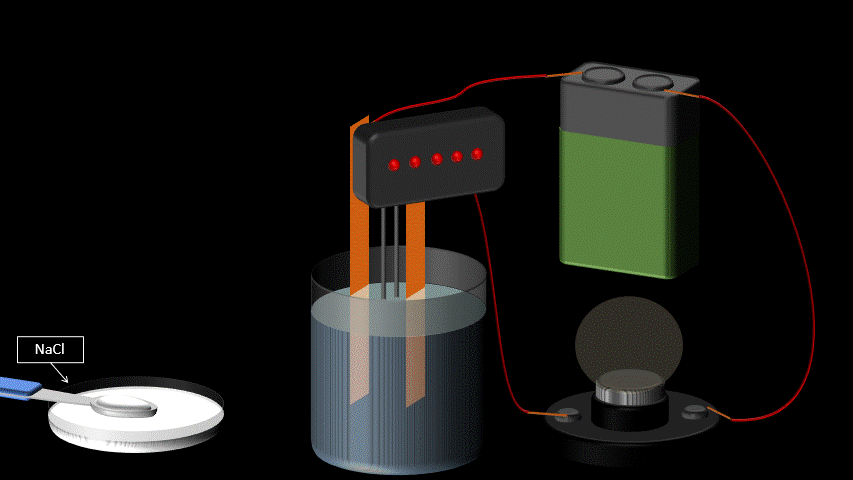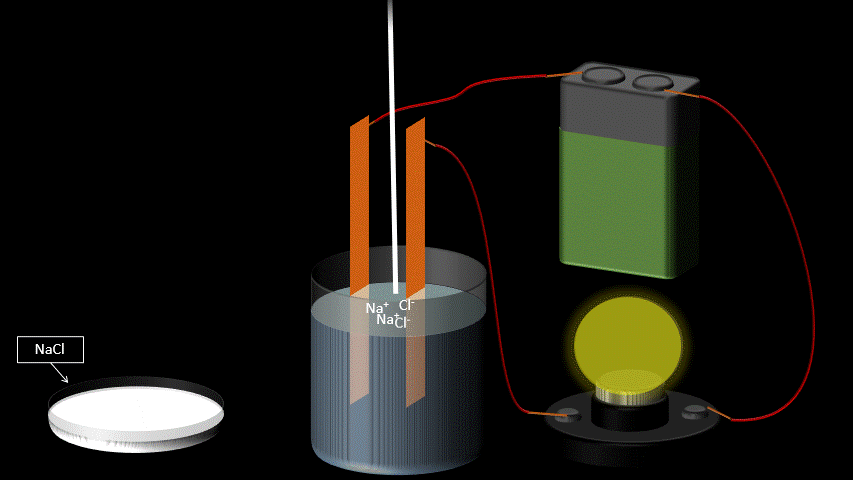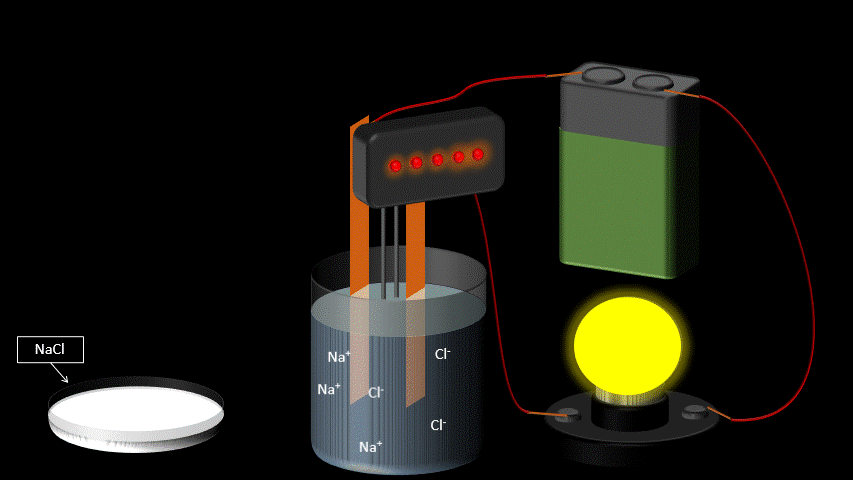
Les électrolytes ont la propriété de conduire le courant électrique lorsqu’on les dissout dans l’eau. Ce ne sont pas des conducteurs électriques à l’état pur: ils doivent être en solution aqueuse pour observer cette propriété.
La conductibilité électrique s’explique par le fait que les molécules d’électrolytes se séparent en deux ions chargés une fois dans l’eau (voir station 1-4 sur la dissociation électrolytique). Par opposition, certaines substances chimiques se dissolvent dans l’eau, mais ne se séparent pas en ions. Elles ne conduisent donc pas le courant électrique en solution aqueuse. On les qualifie de “non-électrolytes”.
On reconnaît trois grands groupes d’électrolytes : les acides, les bases et les sels.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer