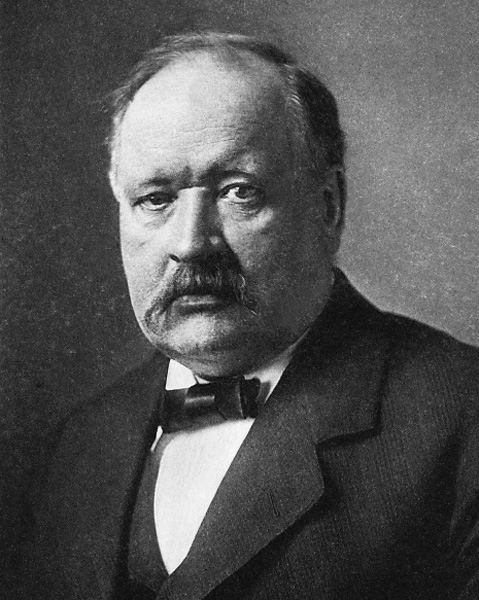M3S4_RE
| Site: | Moodle CSSRDN |
| Cours: | Science 4e secondaire (ST / STE) - 2023-2024 - Douance |
| Livre: | M3S4_RE |
| Imprimé par: | Visiteur anonyme |
| Date: | vendredi 16 janvier 2026, 19:59 |
Description
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. Les électrolytes
Les électrolytes ont la propriété de conduire le courant électrique lorsqu’on les dissout dans l’eau. Ce ne sont pas des conducteurs électriques à l’état pur: ils doivent être en solution aqueuse pour observer cette propriété.
La conductibilité électrique s’explique par le fait que les molécules d’électrolytes se séparent en deux ions chargés une fois dans l’eau (voir station 1-4 sur la dissociation électrolytique). Par opposition, certaines substances chimiques se dissolvent dans l’eau, mais ne se séparent pas en ions. Elles ne conduisent donc pas le courant électrique en solution aqueuse. On les qualifie de “non-électrolytes”.
On reconnaît trois grands groupes d’électrolytes : les acides, les bases et les sels.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer
2. Les acides, les bases et les sels
Les électrolytes se divisent en trois grands groupes, soient les acides, les bases et les sels. Pour les distinguer en laboratoire, il faut effectuer le test du papier de tournesol ou encore mesurer le pH.
Cette vidéo d’Allô Prof décrit en détail le test du papier tournesol et fournit des exemples de résultats obtenus avec des substances courantes :
Pour expliquer le comportement des acides et des bases en solution, on peut se baser sur la théorie de Svante Arrhenius, développée il y a plus d’un siècle. Selon Arrhénius, les acides libèrent des ions H+ en solution aqueuse. Leur formule chimique se présente souvent sous la forme HA. Dans l’eau, la molécule se sépare en ions H+ et A-.
D’autre part, pour Arrhenius, une base est une substance qui libère des ions OH- une fois en solution dans l’eau. Sa formule chimique a la forme BOH où B est un ion positif (très souvent un ion métallique). On appelle l’ion OH- l’ion hydroxyde.
De plus, il définit les acides comme des électrolytes produisant des ions H+ et les bases comme des électrolytes libérant des ions OH-. Sa théorie n’a pas été acceptée d’emblée par la communauté scientifique, mais elle constitue aujourd’hui une clé dans la compréhension des phénomènes électrochimiques.
Ce ne sont pas là ses seuls intérêts : dès 1896, il publie des travaux sur l’effet de serre où il prédit l’effet de l’augmentation du gaz carbonique (CO2) atmosphérique sur la température terrestre. Il se penche aussi sur la diversité des espèces en biologie, se passionne pour la géologie et l’astronomie.
Acides
| Conductibilité | Papier Tournesol | pH | Dissociation électrolytique |
|---|---|---|---|
| De faible à forte | Rouge reste rouge Bleu devient rouge | inférieur à 7 | HA → H+ + A- A : Non-métal ou ion polyatomique |
| Acides | Exemples de dissociation |
|---|---|
| Acide fluorhydrique | HF → H+ + F- |
| Acide chlorhydrique | HCl → H+ + Cl - |
| Acide bromhydrique | HBr → H+ + Br - |
| Acide sulfurique | H2SO4 → 2H+ + SO42- |
| Acide borique | H3BO3 → 3H+ + BO33- |
| Acide acétique | CH3COOH → H+ + CH3COO- |
Bases
| Conductibilité | Papier Tournesol | pH | Dissociation électrolytique |
|---|---|---|---|
| De faible à forte | Rouge devient bleu Bleu reste bleu | supérieur à 7 | BOH → B+ + OH- B : Métal ou NH4+ |
| Bases | Exemples de dissociation |
|---|---|
| Hydroxyde de potassium | KOH → K+ + OH- |
| Hydroxyde de sodium | NaOH → Na+ + OH- |
| Hydroxyde de calcium | Ca(OH)2 → Ca2+ + 2OH- |
| Hydroxyde de magnésium | Mg(OH)2 → Mg2+ + 2OH- |
| Hydroxyde d'aluminium | Al(OH)3 → Al3+ + 3OH- |
| Hydroxyde d'ammonium | NH4OH → NH4+ + OH- |
Sels
| Conductibilité | Papier Tournesol | pH | Dissociation électrolytique |
|---|---|---|---|
| De faible à forte | Rouge reste rouge Bleu reste bleu | =7 | BA → B+ + A- A : Non-métal ou ion polyatomique B : Métal ou NH4+ |
| Sels | Exemples de dissociation |
|---|---|
| Chlorure de potassium | KCl → K+ + Cl- |
| Nitrate de lithium | LiNO3 → Li+ + NO3- |
| Bromure d'ammonium | NH4Br → NH4+ + Br - |
| Nitrite de magnésium | Mg(NO2)2 → Mg2+ + 2NO2- |
| Phosphate de calcium | Ca3(PO4)2 → 3Ca2+ + 2PO43- |
| Acétate de sodium | CH3COONa → Na+ + CH3COO- |
Autres
| Conductibilité | Papier Tournesol | pH | Dissociation électrolytique |
|---|---|---|---|
| Nulle | Rouge reste rouge Bleu reste bleu | =7 | Aucune dissociation |
| Autres | Exemples de dissolution |
|---|---|
| Éthanol (attention, fausse base) | C2H5OH (l) → C2H5OH (aq) |
| Glucose | C6H12O6 (s) → C6H12O6 (aq) |
| Dioxyde de carbone | CO2 (g) → CO2 (aq) |
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer3. Résumé des caractéristiques des trois groupes d’électrolytes
Résumé des caractéristiques des trois groupes d’électrolytes
Après avoir visionné la vidéo, complète ce tableau-synthèse qui se trouve dans ton cahier de notes dans la section synthèse.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer4. STE - Force des électrolytes
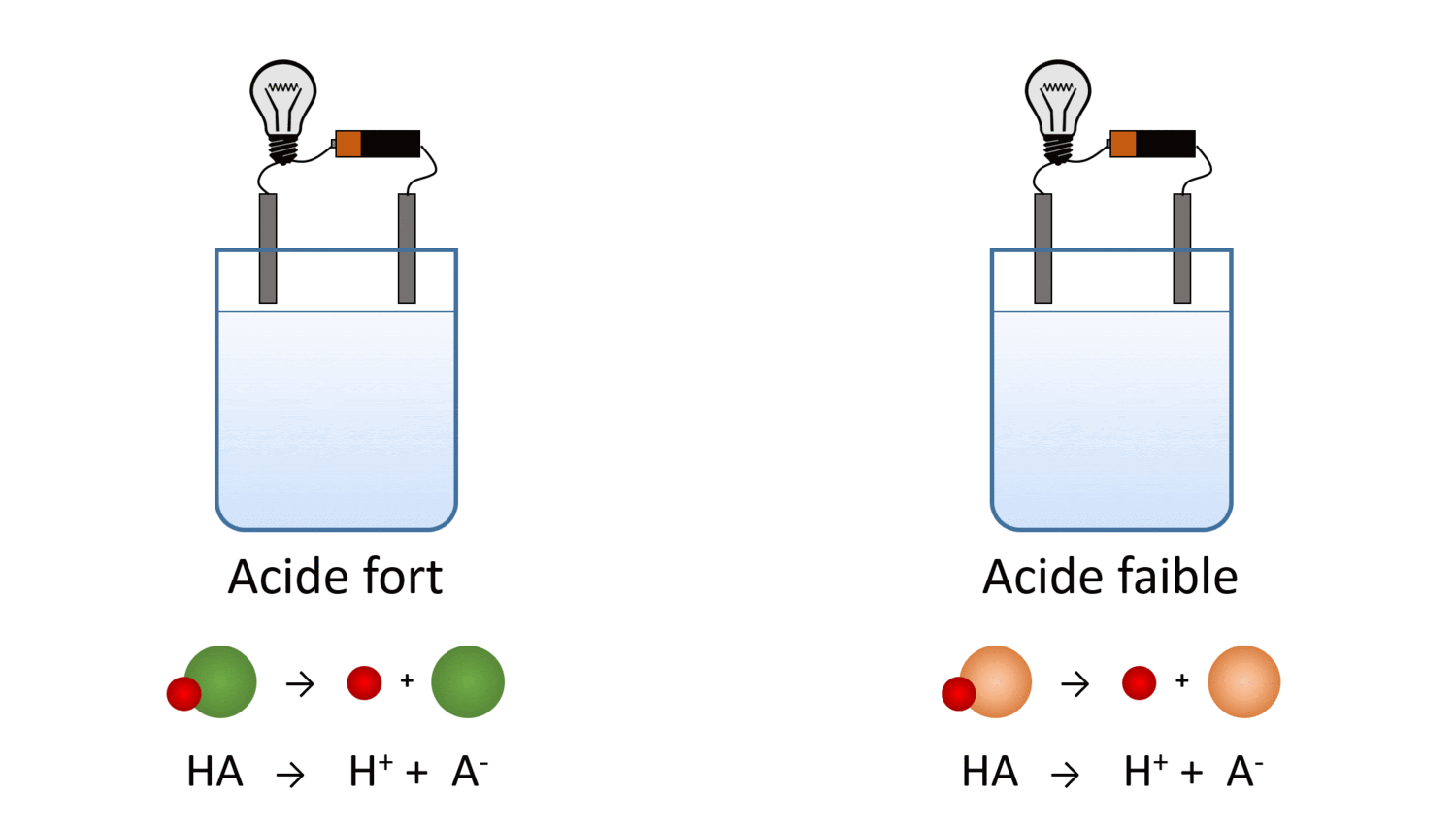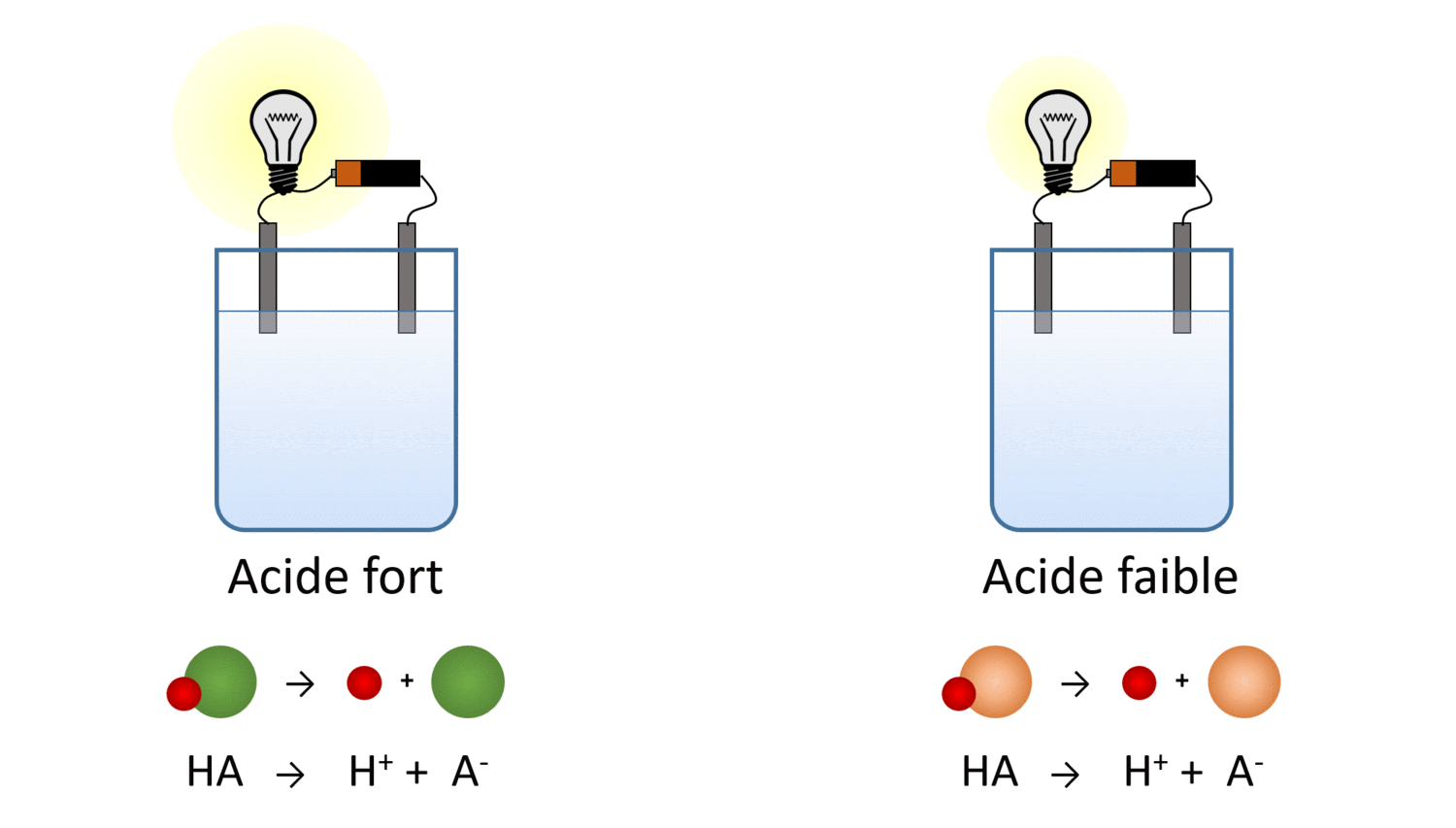
Des solutions acides ayant la même concentration molaire ont-elles la même conductibilité électrique ? Pas nécessairement… Essaie de trouver pourquoi à l’aide de cette simulation.
Va dans la portion “Introduction” de la simulation et sélectionne l’ampoule (dans la section Outil en bas à droite) pour mesurer la conductibilité électrique des cinq liquides. .
Dans cette simulation, les ions H3O + remplacent les ions H +
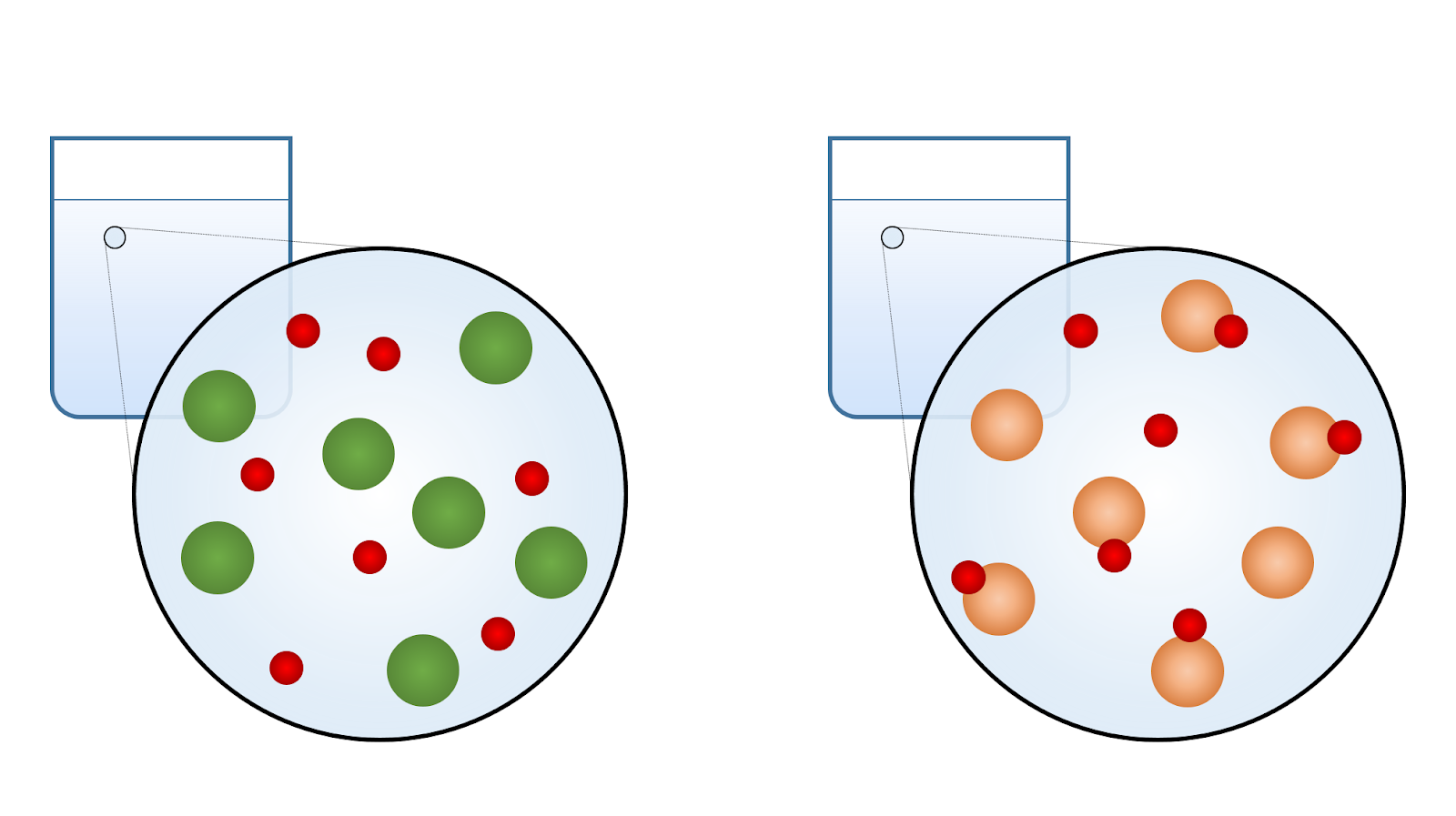
Le laboratoire virtuel t’a peut-être permis de tirer la conclusion suivante : malgré le fait que la quantité de molécules dissoutes est la même, les acides et les bases faibles produisent moins d’ions en solution. Leur conductibilité électrique en est réduite.
Un corollaire de cette conclusion est qu’il existe un lien entre la force d’un acide (ou d’une base) et son pH. Pour une même concentration molaire, l’acide faible libère moins d’ions H+ et a donc un pH plus grand, plus près de 7. Inversement, la base faible libère moins d’ions OH- et son pH est plus faible, aussi plus près de 7.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer5. Dissolution électrolytique
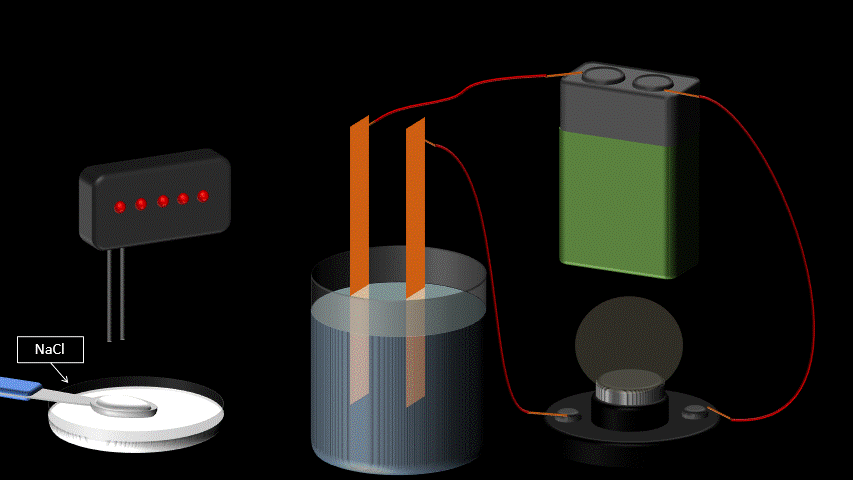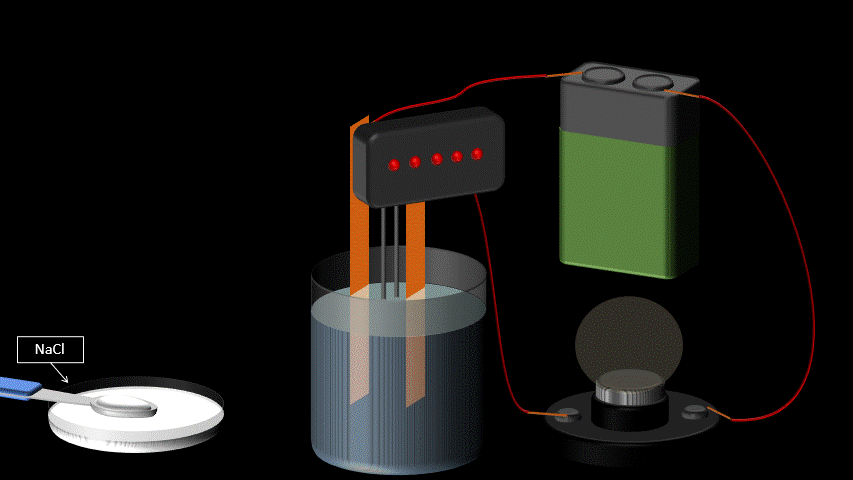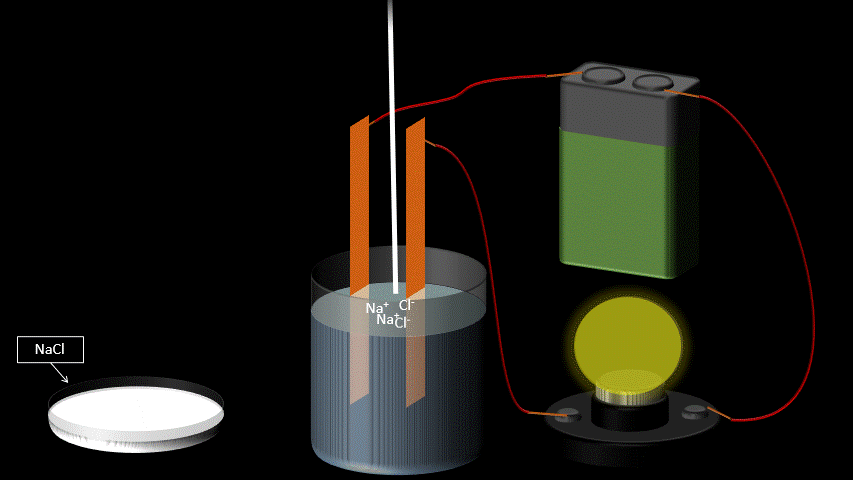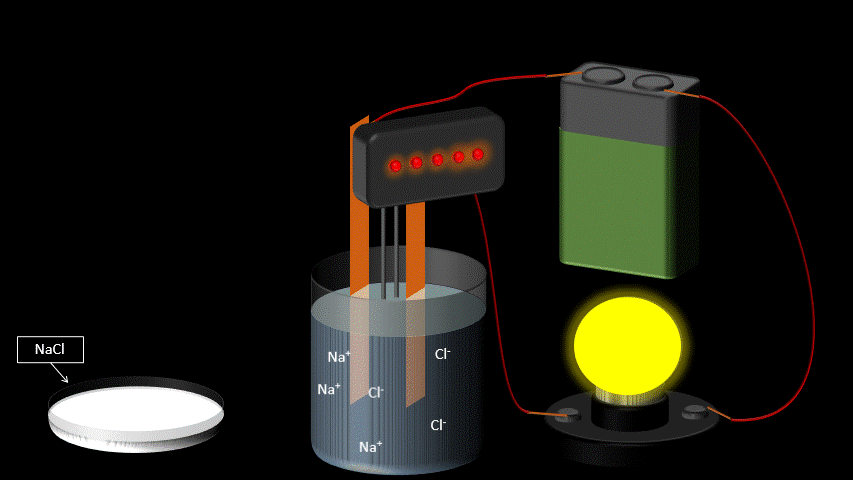
Certaines molécules se séparent en ions (positifs et négatifs) lorsqu’on les dissout dans l’eau. C’est ce qu’on appelle la dissociation électrolytique.
Attention ! Il ne faut pas confondre dissolution et dissociation. La dissolution se voit à l’œil nu : la substance (soluté) et le solvant forment un mélange homogène (une solution) et on ne peux plus les distinguer. Certaines substances chimiques se dissolvent dans l’eau, mais leur molécules ne se dissocient pas pour autant. C'est le cas par exemple du sucre, du dioxyde de carbone ou de l'alcool.
C6H12O6 (solide) → C6H12O6 (aqueux)
Au contraire, les sels, les acides et les bases se dissocient, c'est-à-dire qu'ils libèrent des ions en solution aqueuse (dans l'eau).
NaCl (solide) → Na+ (aqueux) + Cl- (aqueux)
Observe différents solutés dans ce laboratoire virtuel pour répondre aux questions.

Section “Macro”
Section “Micro”
Section “Eau”
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer6. Le courant et la conductibilité électrique
Le courant électrique, c’est un mouvement ordonné de charges électriques, souvent des électrons. Si on applique une force électromotrice aux extrémités d’un matériau qui laisse passer le courant électrique, les charges vont se déplacer dans une direction précise à l’intérieur du matériau. La force électromotrice, ou différence de potentiel, peut être fournie par une pile électrique.
On dira d’un matériau qui laisse passer le courant électrique que c’est un conducteur ou qu’il a une bonne conductibilité électrique. À l’inverse, un matériau qui ne laisse peu ou pas circuler de charges électriques est un isolant et a une mauvaise conductibilité électrique
Voici quelques exemples de substances conductrices :
- Métaux (cuivre, argent, or, aluminium…)
- Eau salée
- Vinaigre
Voici quelques exemples de substances isolantes :
- Air
- Eau pure
- Plastique
- Bois
- Caoutchouc
- Verre
Cette vidéo d’Allô Prof résume ces notions :
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer7. La conductibilité électrique dans une solution
Certains liquides conduisent le courant électrique et d’autres non. Pourquoi ?
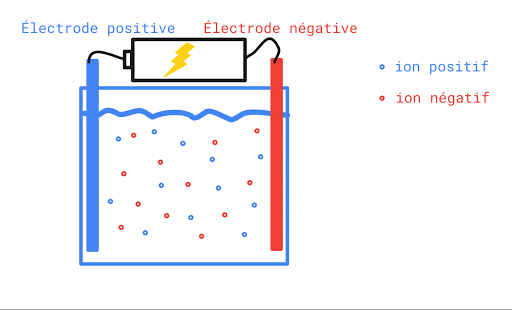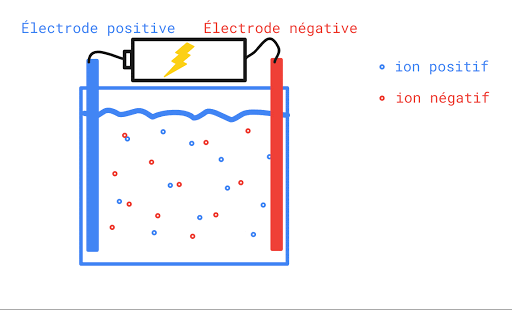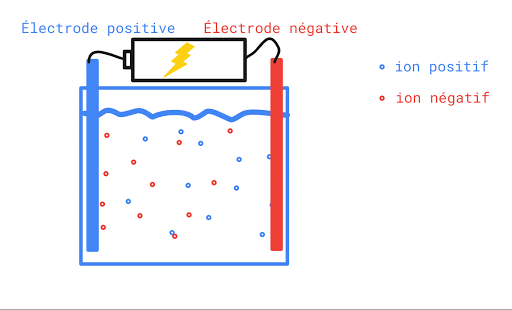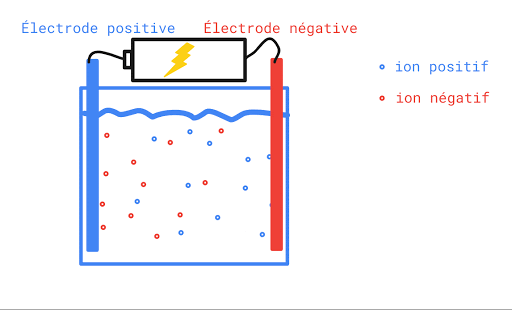
L’eau pure n’est pas conductrice car elle ne contient pas d’ions (de particules portant une charge électrique). Si on ajoute du sel à l’eau pure, elle devient conductrice. Ceci s’explique par le fait qu’une fois en solution, la molécule de sel se sépare en deux ions qui portent chacun une charge électrique. L’un est positif, l’autre, négatif. Lorsqu’on applique une différence de potentiel entre deux électrodes trempées dans la solution de sel, les cations (Na+) se déplaceront vers l’électrode négative et les anions (Cl-) se dirigeront vers l’électrode positive. Le mouvement des charges qui s’effectue dans la solution est un courant électrique.
Toute solution aqueuse qui contient un électrolyte, c’est-à-dire une substance qui se sépare en ions positifs et négatifs une fois dans l’eau, laissera passer le courant électrique et sera conductrice.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer
8. Synthèse
Astuce!
Tu veux réussir mieux ! Prends le temps de consigner dans le cahier de notes l'ensemble de tes apprentissages. Tu auras ainsi un cahier non seulement ordonné, mais aussi imprimable. De plus, le fait de résumer, d'expliquer, de synthétiser la matière te permet de mieux l'assimiler. Ton temps d'étude en sera sans aucun doute réduit!
Important : Lorsque tu prends des notes dans ton cahier, tu dois toujours cliquer sur "enregistrer" pour les conserver. Une fois tes notes compilées, n'oublie pas de cocher la boite à côté de cette ressource afin d'avoir accès au test de validation de la station.