M3S4_RE
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
7. La conductibilité électrique dans une solution
Certains liquides conduisent le courant électrique et d’autres non. Pourquoi ?
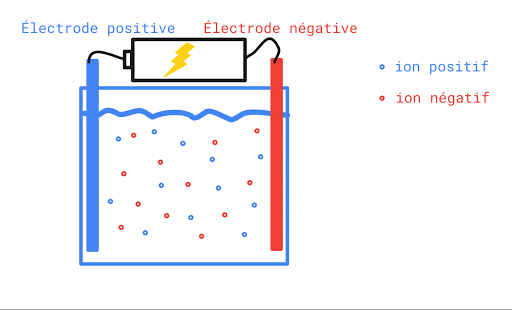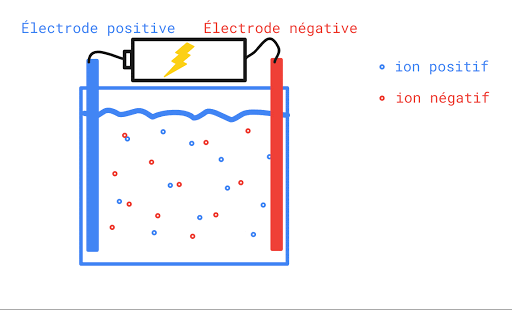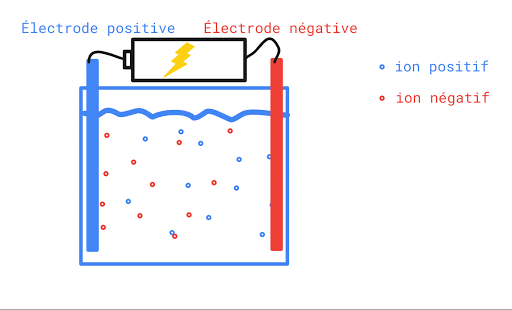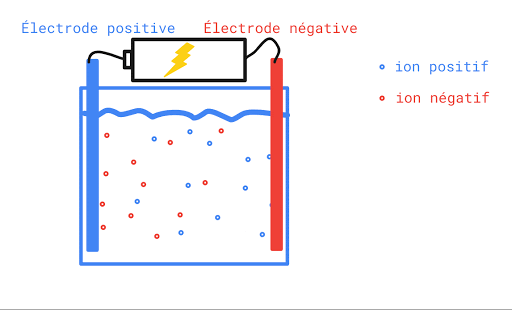
L’eau pure n’est pas conductrice car elle ne contient pas d’ions (de particules portant une charge électrique). Si on ajoute du sel à l’eau pure, elle devient conductrice. Ceci s’explique par le fait qu’une fois en solution, la molécule de sel se sépare en deux ions qui portent chacun une charge électrique. L’un est positif, l’autre, négatif. Lorsqu’on applique une différence de potentiel entre deux électrodes trempées dans la solution de sel, les cations (Na+) se déplaceront vers l’électrode négative et les anions (Cl-) se dirigeront vers l’électrode positive. Le mouvement des charges qui s’effectue dans la solution est un courant électrique.
Toute solution aqueuse qui contient un électrolyte, c’est-à-dire une substance qui se sépare en ions positifs et négatifs une fois dans l’eau, laissera passer le courant électrique et sera conductrice.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer