M2S1_RE
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. Atome et modèle atomique (rappel)
1.1 Les particules de l'atome
Nous avons vu dans le module 1 qu'il existait trois particules élémentaires dans l'atomes : le proton, le neutron et l'électron. À noter que l'étude du neutron ne se fait que dans le cadre du cours STE.
| Particule | Charge | Emplacement | Rôle |
|---|---|---|---|
| Proton | Positive | Dans le noyau | Détermine la nature de l'atome. |
| Électron | Négative | En périphérie | Détermine la réactivité chimique de l'atome. |
| Neutron (STE) | Neutre | Dans le noyau | Assure la cohésion du noyau. |
1.2 Le modèle atomique
Selon le modèle de Rutherford-Bohr, l’atome a un noyau massif composé de particules ayant une charge électrique positive, appelées protons. Des particules beaucoup plus légères se déplacent autour de ce noyau sur différentes couches. Ce sont les électrons.
L’atome est électriquement neutre, c’est-à-dire qu’il a autant de charges positives (protons) que de charges négatives (électrons). Pour connaître le nombre de protons (et d’électrons) d’un atome donné, il suffit de regarder le numéro atomique de cet élément dans le tableau périodique. En effet, chaque élément du tableau périodique a un nombre de protons caractéristiques. Par exemple, un atome d’hydrogène a toujours 1 proton, un atome d’hélium a 2 protons, alors que l’oxygène compte 8 protons.
Plus l’atome a d’électrons, plus il compte de couches électroniques. Pour les 20 premiers éléments du tableau périodique, les électrons sont distribués sur les couches de la façon suivante. Les deux premiers électrons sont placés sur la 1ère couche électronique, la plus proche du noyau. Les huit électrons suivants seront placés sur la 2e couche électronique, un peu plus loin du noyau. Les huit électrons suivants sont positionnés sur une 3e couche électronique. S’il reste des électrons, ils seront localisés sur une 4e couche.
Par exemple, l’azote a 7 électrons :
- 1ère couche, 2 électrons
- 2e couche, 5 électrons
Le potassium a 19 électrons :
- 1ère couche, 2 électrons
- 2e couche, 8 électrons
- 3e couche, 8 électrons
- 4e couche, 1 électron
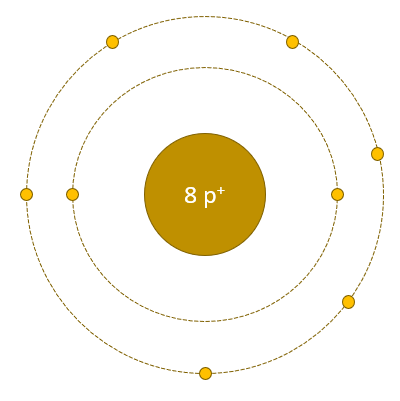
L'oxygène a 8 électrons :
- 1ère couche, 2 électrons
- 2e couche, 6 électrons
1.3 Les électrons de valence
Les électrons de la couche la plus éloignée du noyau ont une importance particulière. Ce sont eux qui sont impliqués dans les interactions avec les autres atomes et donc dans la réactivité chimique de l’élément. On les appelle les électrons de valence.
Le nombre d’électrons de valence peut être déterminé facilement en se fiant à la famille de l’élément dans le tableau périodique. Pour les familles IA, IIA, IIIA, IVA, VA, VIA, VIIA et VIIIA, le nombre d’électrons de valence correspond au chiffre romain du groupe. Par exemple, l’azote de la famille VA a 5 électrons de valence. Il existe une seule exception, l’hélium, un gaz inerte de la famille VIIIA, qui n’a que 2 électrons de valence.