M2S1_RE
| Site: | Moodle CSSRDN |
| Cours: | Science 4e secondaire (ST / STE) - 2023-2024 |
| Livre: | M2S1_RE |
| Imprimé par: | Visiteur anonyme |
| Date: | lundi 9 mars 2026, 01:42 |
Description
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. Atome et modèle atomique (rappel)
1.1 Les particules de l'atome
Nous avons vu dans le module 1 qu'il existait trois particules élémentaires dans l'atomes : le proton, le neutron et l'électron. À noter que l'étude du neutron ne se fait que dans le cadre du cours STE.
| Particule | Charge | Emplacement | Rôle |
|---|---|---|---|
| Proton | Positive | Dans le noyau | Détermine la nature de l'atome. |
| Électron | Négative | En périphérie | Détermine la réactivité chimique de l'atome. |
| Neutron (STE) | Neutre | Dans le noyau | Assure la cohésion du noyau. |
1.2 Le modèle atomique
Selon le modèle de Rutherford-Bohr, l’atome a un noyau massif composé de particules ayant une charge électrique positive, appelées protons. Des particules beaucoup plus légères se déplacent autour de ce noyau sur différentes couches. Ce sont les électrons.
L’atome est électriquement neutre, c’est-à-dire qu’il a autant de charges positives (protons) que de charges négatives (électrons). Pour connaître le nombre de protons (et d’électrons) d’un atome donné, il suffit de regarder le numéro atomique de cet élément dans le tableau périodique. En effet, chaque élément du tableau périodique a un nombre de protons caractéristiques. Par exemple, un atome d’hydrogène a toujours 1 proton, un atome d’hélium a 2 protons, alors que l’oxygène compte 8 protons.
Plus l’atome a d’électrons, plus il compte de couches électroniques. Pour les 20 premiers éléments du tableau périodique, les électrons sont distribués sur les couches de la façon suivante. Les deux premiers électrons sont placés sur la 1ère couche électronique, la plus proche du noyau. Les huit électrons suivants seront placés sur la 2e couche électronique, un peu plus loin du noyau. Les huit électrons suivants sont positionnés sur une 3e couche électronique. S’il reste des électrons, ils seront localisés sur une 4e couche.
Par exemple, l’azote a 7 électrons :
- 1ère couche, 2 électrons
- 2e couche, 5 électrons
Le potassium a 19 électrons :
- 1ère couche, 2 électrons
- 2e couche, 8 électrons
- 3e couche, 8 électrons
- 4e couche, 1 électron
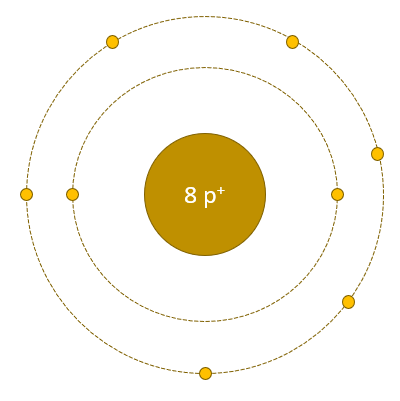
L'oxygène a 8 électrons :
- 1ère couche, 2 électrons
- 2e couche, 6 électrons
1.3 Les électrons de valence
Les électrons de la couche la plus éloignée du noyau ont une importance particulière. Ce sont eux qui sont impliqués dans les interactions avec les autres atomes et donc dans la réactivité chimique de l’élément. On les appelle les électrons de valence.
Le nombre d’électrons de valence peut être déterminé facilement en se fiant à la famille de l’élément dans le tableau périodique. Pour les familles IA, IIA, IIIA, IVA, VA, VIA, VIIA et VIIIA, le nombre d’électrons de valence correspond au chiffre romain du groupe. Par exemple, l’azote de la famille VA a 5 électrons de valence. Il existe une seule exception, l’hélium, un gaz inerte de la famille VIIIA, qui n’a que 2 électrons de valence.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer2. Les ions et la règle de l'octet
2.1 La stabilité des gaz inertes et la loi de l'octet
Regarde la vidéo ci-dessous pour apprendre un peu plus sur la règle d'octet.
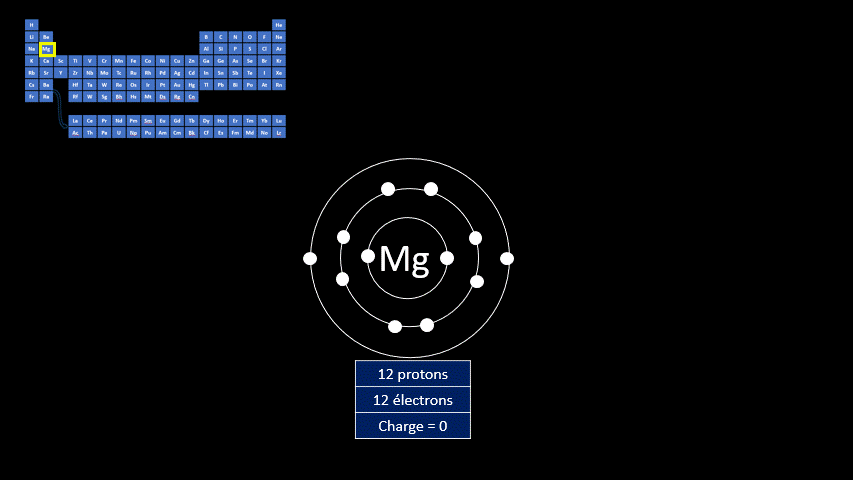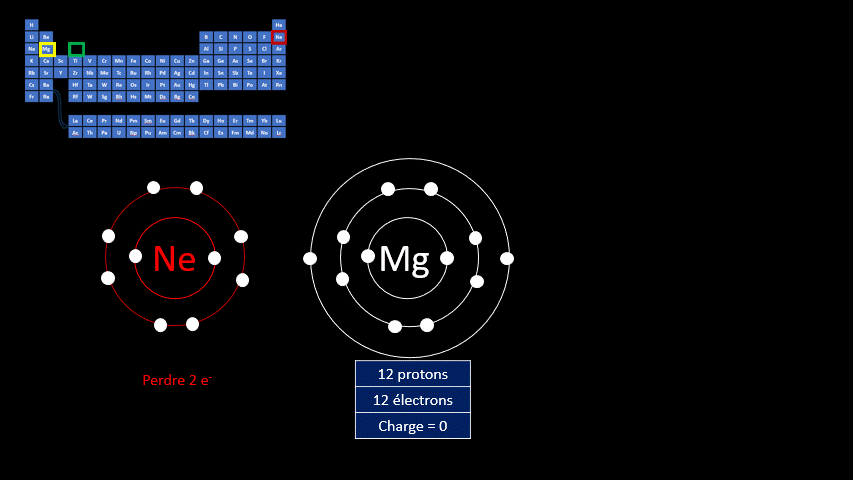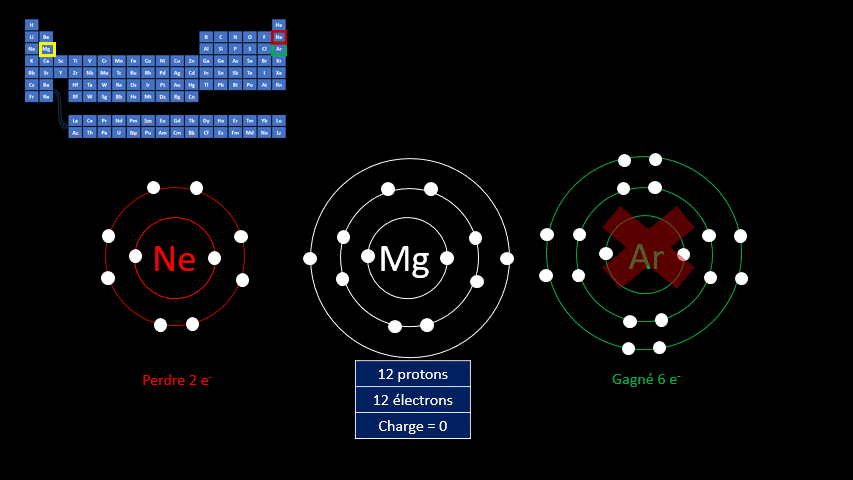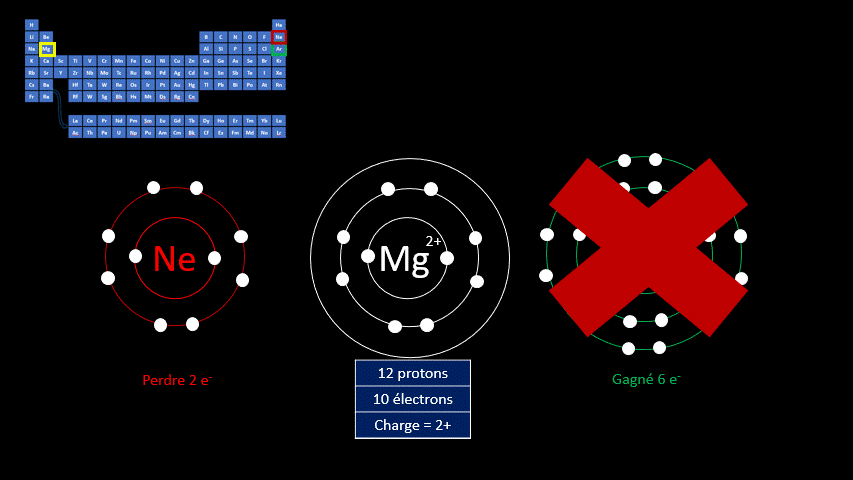
Les atomes sont électriquement neutres, mais ce n’est pas le cas des ions. Ces atomes (ou ces groupes d’atomes) portent une charge électrique positive ou négative.
Les ions monoatomiques (mono signifie un, donc un ion n'ayant qu'un seul atome) sont formés lorsqu’un atome gagne ou perd au moins un électron. La règle de l'octet précise que tous les atomes cherchent à avoir leur dernière couche électronique complète pour être chimiquement plus stable. Pour y arriver, ils peuvent perdre ou gagner des électrons. Toutefois, en changeant leur nombre d'électrons ils ne sont plus électriquement neutres (il n'y a plus autant de protons que d'électrons). Ils ne peuvent donc plus être appelés "atomes". On doit alors les appeler "ions". Un ion est donc un atome dont la dernière couche est complète, mais dont le nombre de protons n'est pas égal au nombre d'électrons. Ils adoptent alors la configuration électronique (c’est-à-dire la répartition des électrons) propre aux gaz inertes. Les couches électroniques de ceux-ci sont pleines. Ils ont donc huit électrons de valence, à l’exception de l’hélium qui n’en a que deux.
Par exemple, le fluor a 9 protons et 9 électrons. Il serait plus stable chimiquement s’il possédait un électron supplémentaire, comme le néon qui le suit dans le tableau périodique. Lorsqu’il gagne un électron, l’atome de fluor devient l’ion F - et a la même configuration électronique que le néon. Son nombre de protons est toujours de 9, mais son nombre d’électrons s’élève à 10. Sa charge électrique globale est donc de -1 (+9 -10 = -1)
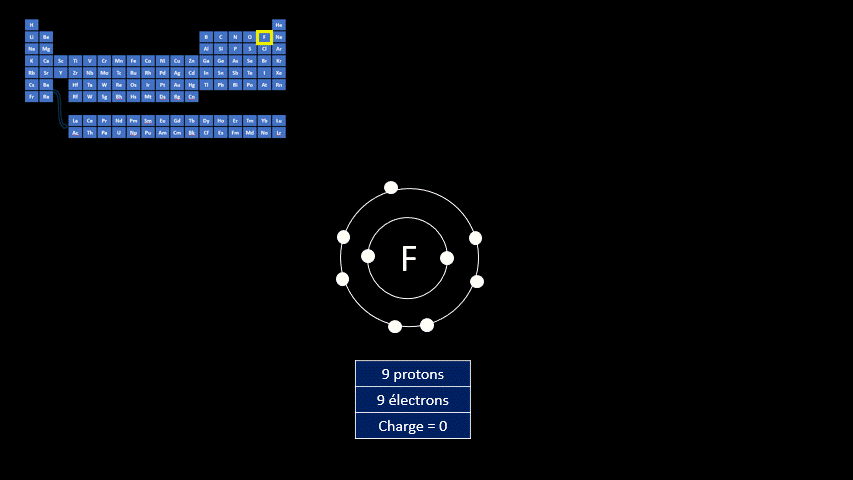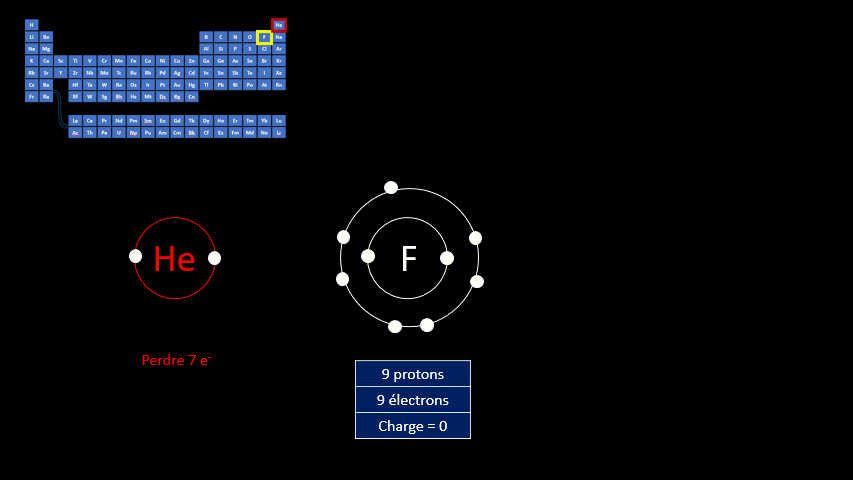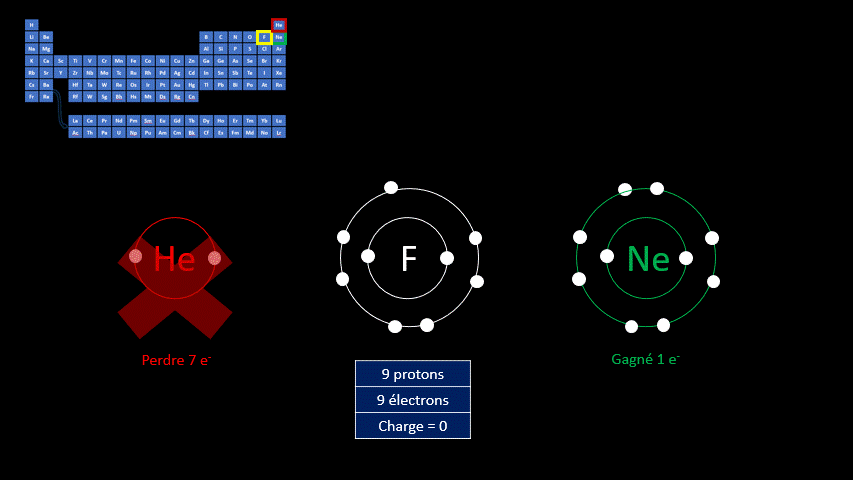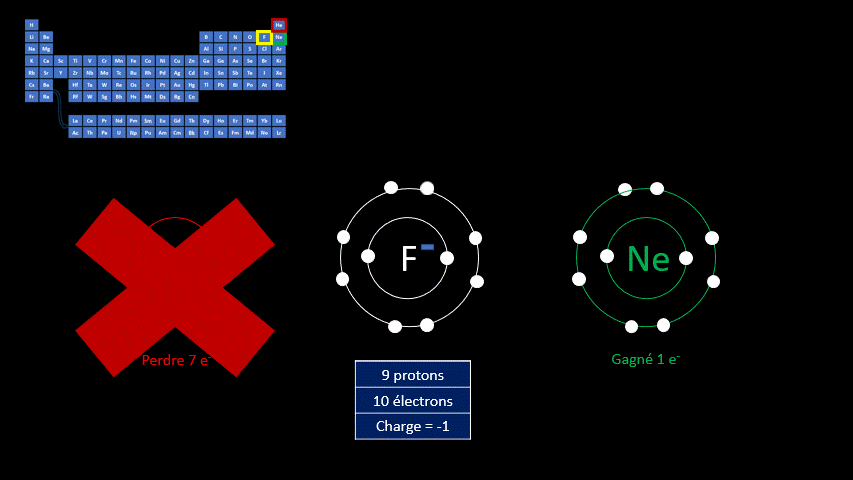
On distingue donc deux grands groupes d’ions : ceux qui portent une charge électrique négative, appelés anions, et ceux qui ont une charge positive, appelés cations. Le tableau suivant résume les caractéristiques des ions monoatomiques des deux groupes.
| # | Cation | Anion |
|---|---|---|
| Charge | Positive | Négative |
| Perte ou gain d'électron(s) | Perte | Gain |
| Famille du tableau périodique | I, IIA, IIIA | VA, VIA, VIIA |
| Exemple | Li+, Ca2+, Al3+ | F-, Se2-, P3- |
2.2 Les ions
Les élèves de ST peuvent manipuler que les protons et les électrons pour répondre aux questions.
À l'aide de la section “Construire un atome”, répondez aux questions suivantes :
Observe tes résultats. Vois-tu une tendance ? Pourrais-tu déduire la charge de l'ion brome, par exemple ?

2.3 Exercice récapitulatif
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer3. Synthèse
Astuce!
Tu veux réussir mieux ! Prends le temps de consigner dans le cahier de notes l'ensemble de tes apprentissages. Tu auras ainsi un cahier non seulement ordonné, mais aussi imprimable. De plus, le fait de résumer, d'expliquer, de synthétiser la matière te permet de mieux l'assimiler. Ton temps d'étude en sera sans aucun doute réduit!
Important : Lorsque tu prends des notes dans ton cahier, tu dois toujours cliquer sur "enregistrer" pour les conserver. Une fois tes notes compilées, n'oublie pas de cocher la boite à côté de cette ressource afin d'avoir accès au test de validation de la station.