M3S3_RE
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
2. Les ions et la règle de l’octet (ou du doublet)
Regarde la vidéo ci-dessous pour apprendre un peu plus sur la règle d'octet
Les atomes sont électriquement neutres, mais ce n’est pas le cas des ions. Ces atomes (ou ces groupes d’atomes) portent une charge électrique positive ou négative.
Les ions monoatomiques sont formés à partir d’un atome qui a gagné ou perdu au moins un électron. La règle de l’octet peut expliquer la formation de ces ions. Les atomes sont plus stables lorsqu’ils adoptent la configuration électronique (c’est-à-dire la répartition des électrons) propre aux gaz inertes. Les éléments de cette famille chimique ont tous une couche électronique externe complète. Ils ont donc huit électrons de valence, à l’exception de l’hélium qui n’en a que deux.
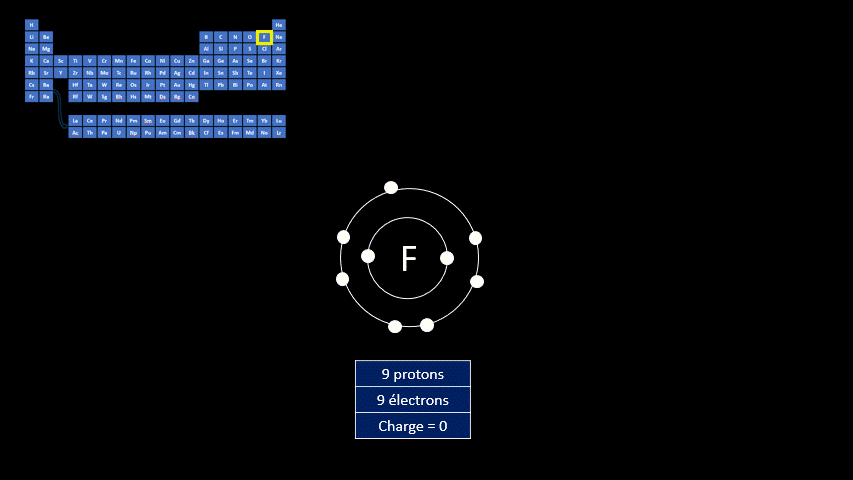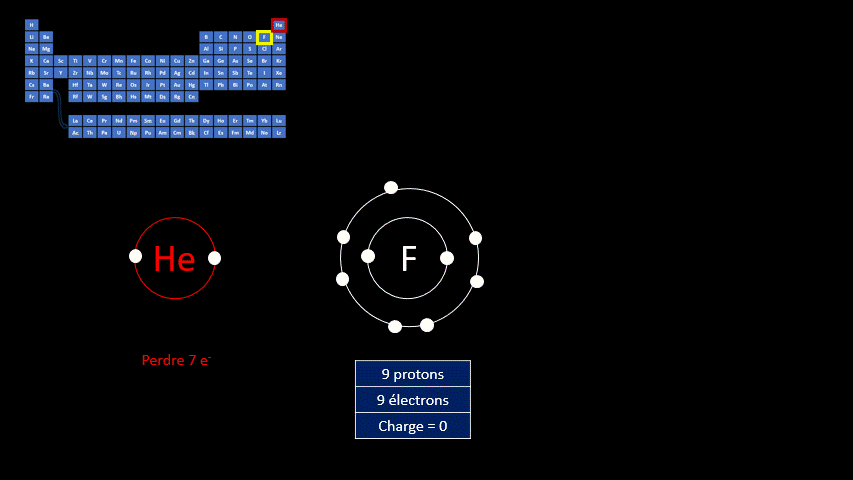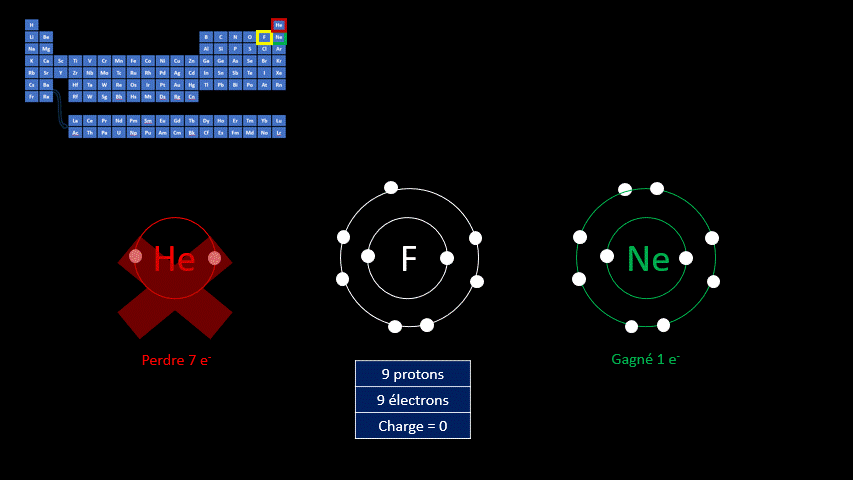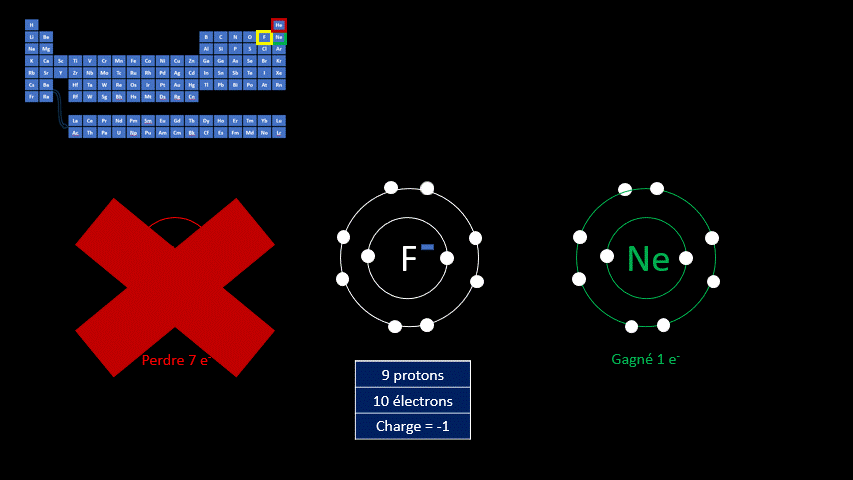
Par exemple, le fluor a 9 protons et 9 électrons. Il serait plus stable chimiquement s’il possédait un électron supplémentaire, comme le néon qui le suit dans le tableau périodique. Lorsqu’il gagne un électron, l’atome de fluor devient l’ion F - et a la même configuration électronique que le néon. Son nombre de protons est toujours de 9, mais son nombre d’électrons s’élève à 10. Sa charge électrique globale est donc de -1 (+9 -10 = -1)
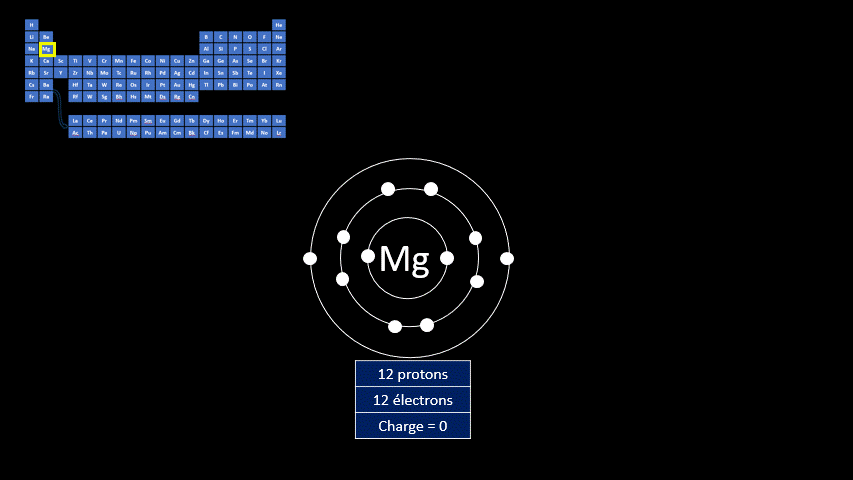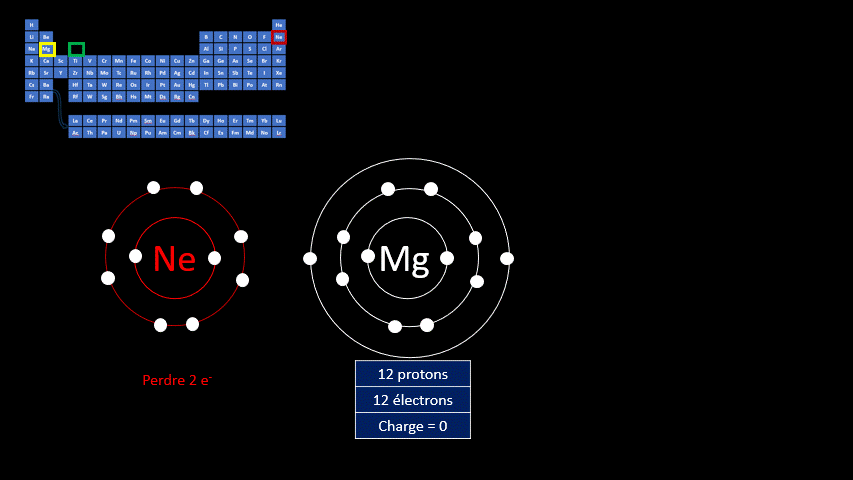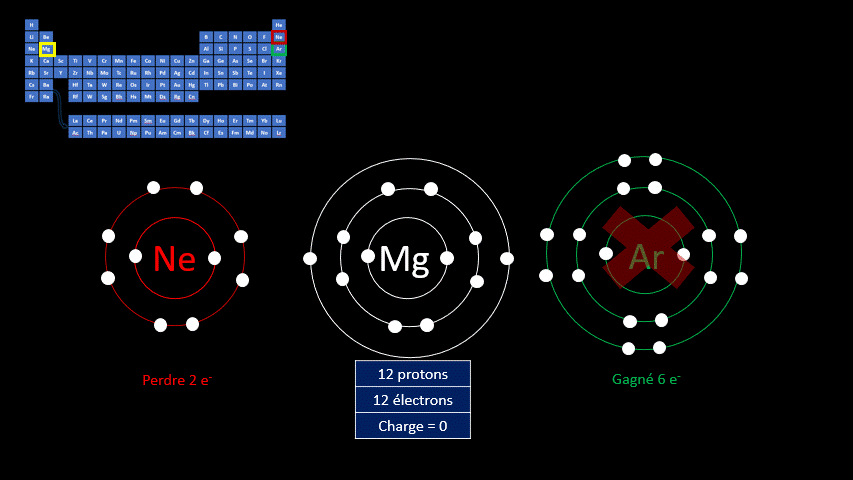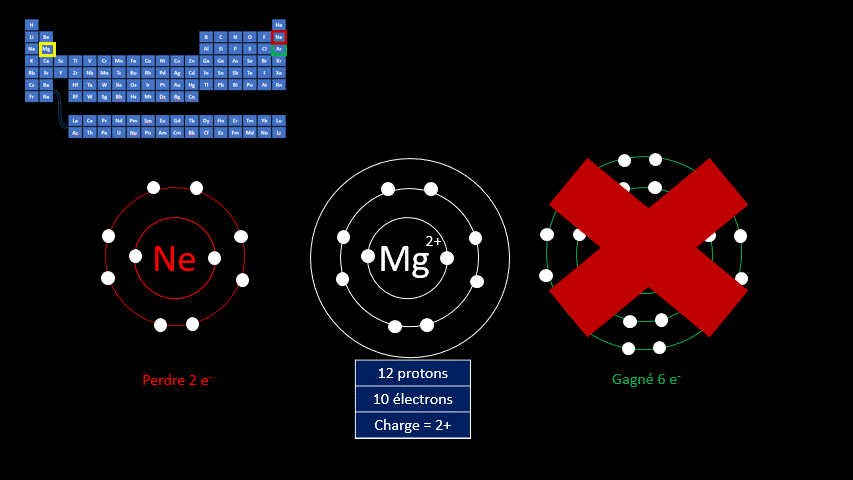
Le fluor a donc tendance à capter un électron, mais d’autres éléments gagnent en stabilité lorsqu’ils perdent des électrons. L’atome de magnésium compte 20 protons et 20 électrons. Le gaz inerte qui s’en rapproche le plus est le néon qui n’a que 8 électrons.
L’atome de magnésium a tendance à perdre 2 électrons pour former l’ion
.
On distingue donc deux grands groupes d’ions : ceux qui portent une charge électrique négative, appelés anions, et ceux qui portent une charge positive, appelés cations. Le tableau suivant résume les caractéristiques des ions monoatomiques des deux groupes.
| Cations | Anions | |
|---|---|---|
| Charge électrique | Positive | Négative |
| Perte ou gain d’électron(s) | Perte | Gain |
| Familles du tableau périodique | IA, IIA, IIIA | VA, VIA, VIIA |
| Exemples | Li + , Ca 2+ , Al 3+ | F - , Se 2- , P 3- |