M2S2_RE
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
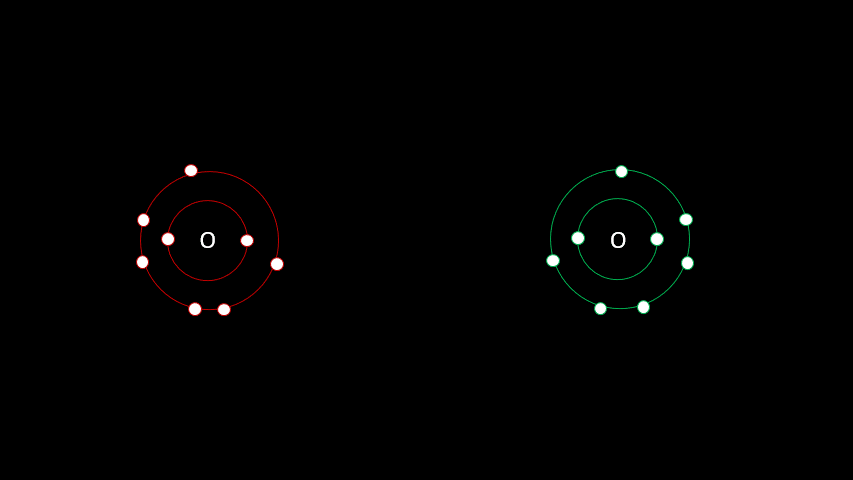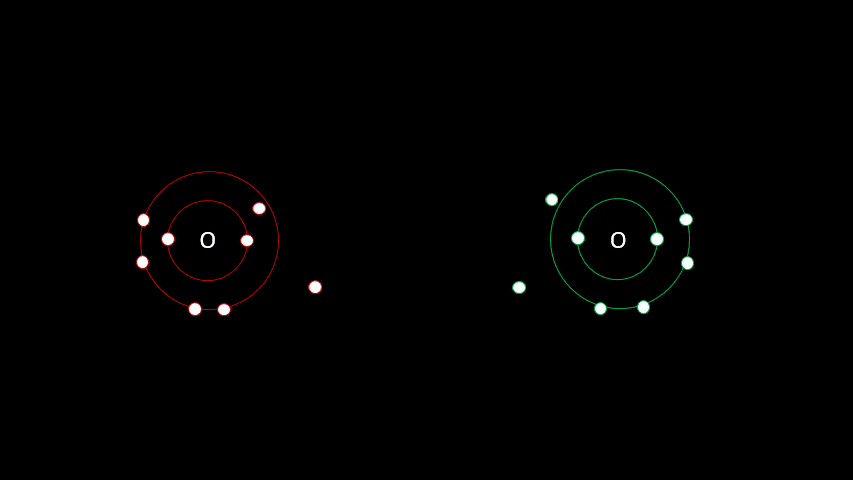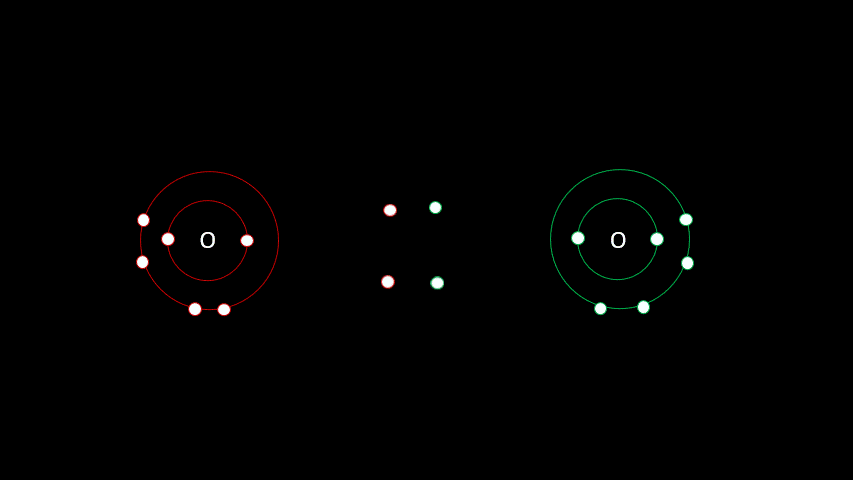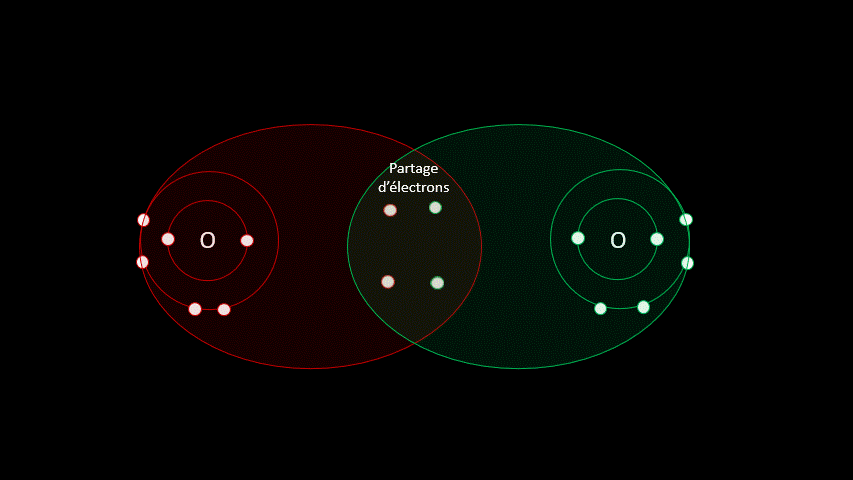
3. Liaisons covalentes
3.1 Une question de partage
Certaines liaisons chimiques vont unir deux receveurs. C'est le cas notamment de plusieurs gaz diatomiques comme le H2, le O2, le N2, le I2 ou le Cl2. Dans ces cas-ci, la différence d'électronégativité est faible puisqu'on a affaire à deux receveurs d'électrons. On parle alors de liaison covalente, liaison où les atomes partagent un ou plusieurs électrons. Outre les gaz diatomiques, les molécules constituées de deux non-métaux sont liées de façon covalente (H2O, CO2, CH4).