M2S2_RE
| Site: | Moodle CSSRDN |
| Cours: | Science 4e secondaire (ST / STE) - 2023-2024 |
| Livre: | M2S2_RE |
| Imprimé par: | Visiteur anonyme |
| Date: | lundi 9 mars 2026, 14:06 |
Description
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. L'électronégativité
1.1 Tirer sur ses électrons
Un atome, c'est composé de protons positifs et d'électrons négatifs. On le sait, les charges contraires s'attirent. L'électronégativité, c'est donc un indice de la force avec laquelle l'atome attire les électrons des autres atomes dans une liaison chimique. Les atomes dont l'électronégativité est élevée sont des arracheur d'électrons. Ce sont donc les protons, contenus dans le noyau, qui attirent les électrons. Plus il y a de protons, plus les électrons sont attirés et plus ce sera difficile de les arracher à l'atome. L'électronégativité augmente donc en se déplaçant de gauche à droite du tableau.
Plus les électrons sont éloignés du noyau, moins ils sont attirés par celui-ci et plus il sera facile de les arracher à l'atome. L'électronégativité diminue lorsqu'on se déplace de haut en bas du tableau.

Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer2. Liaisons ioniques
2.1 Des receveurs et des donneurs
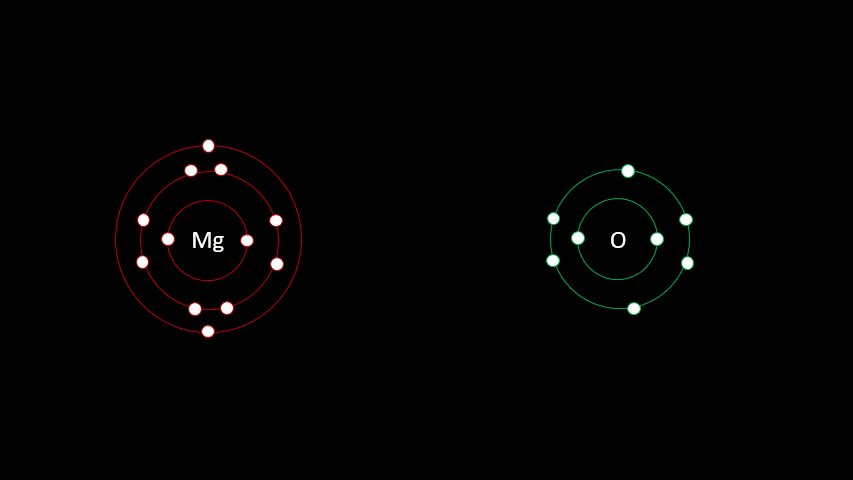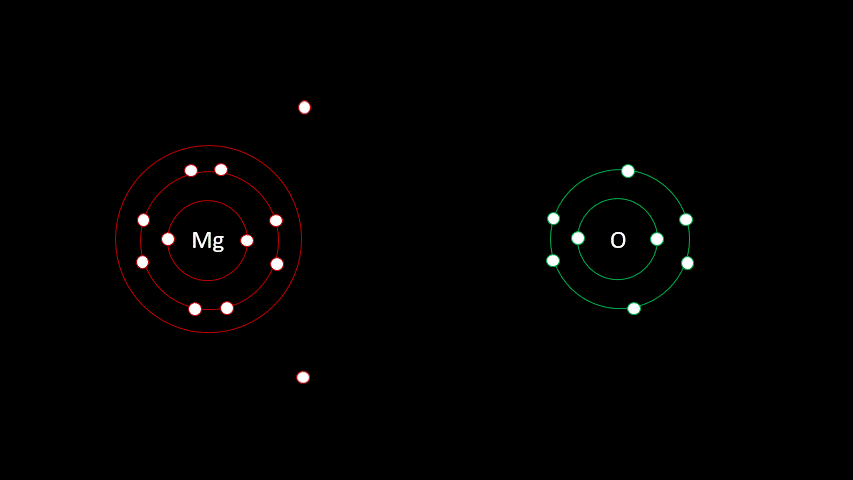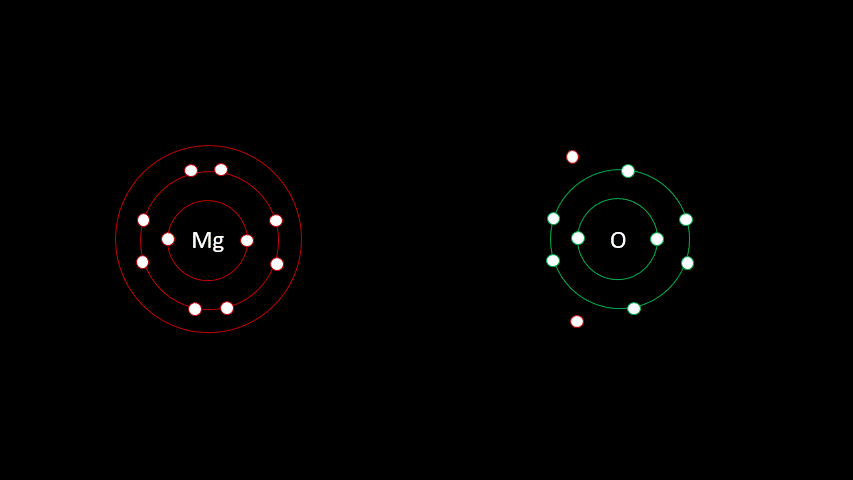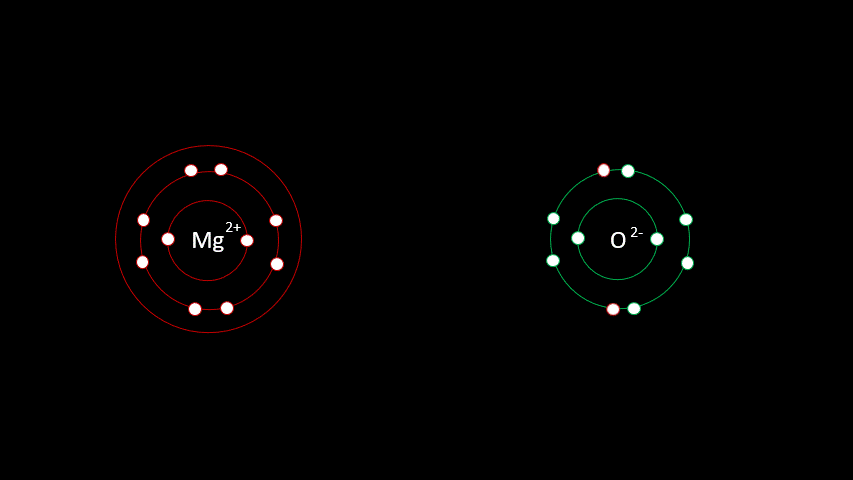
On a vu dans la dernière section que ce sont les électrons de la dernière couche électronique qui interviendront dans les liaisons chimiques. Ainsi, certains atomes, principalement les métaux, auront une tendance naturelle à donner des électrons. D'autres atomes, principalement les non-métaux, auront une tendance naturelle à les recevoir. Tout ça, c'est une question d'électronégativité. Ainsi, lorsqu'un atome a une électronégativité beaucoup plus grande que l'autre, il se formera alors une liaison ionique. Logiquement, vous comprendrez que cette liaison unit généralement un métal à un non-métal. Le but est toujours de respecter la règle de l'octet et d'avoir la configuration électronique du gaz inerte le plus proche.
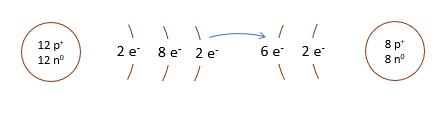
L'atome de magnésium contient 12 protons et 12 électrons. En observant la configuration électronique du magnésium, on remarque qu'il a 2 électrons sur sa dernière couche. Il est plus facile pour lui de perdre deux électrons que d'en gagner six afin que sa configuration électronique ressemble au néon, d'autant plus qu'étant à gauche du tableau, son électronégativité est faible.
2.2 Un peu d'exercices
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer3. Liaisons covalentes
3.1 Une question de partage
Certaines liaisons chimiques vont unir deux receveurs. C'est le cas notamment de plusieurs gaz diatomiques comme le H2, le O2, le N2, le I2 ou le Cl2. Dans ces cas-ci, la différence d'électronégativité est faible puisqu'on a affaire à deux receveurs d'électrons. On parle alors de liaison covalente, liaison où les atomes partagent un ou plusieurs électrons. Outre les gaz diatomiques, les molécules constituées de deux non-métaux sont liées de façon covalente (H2O, CO2, CH4).
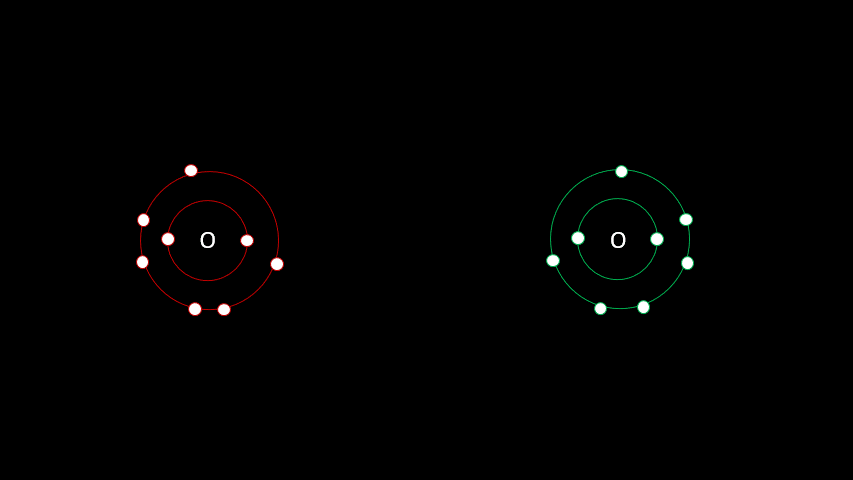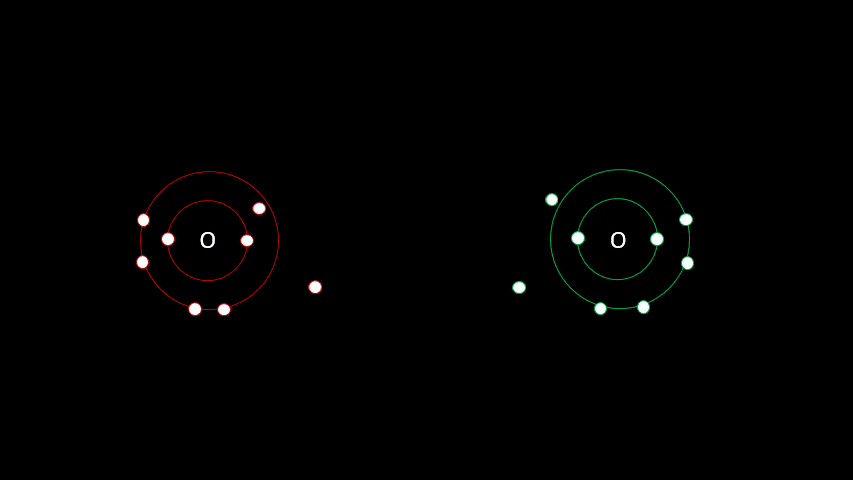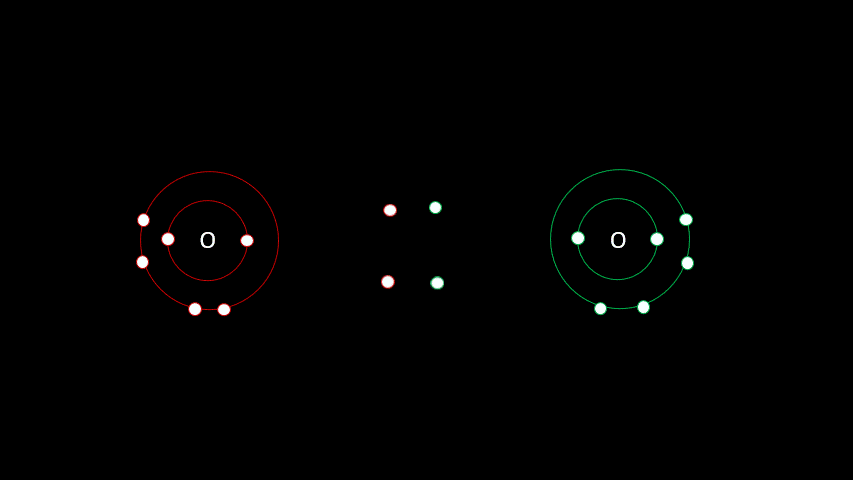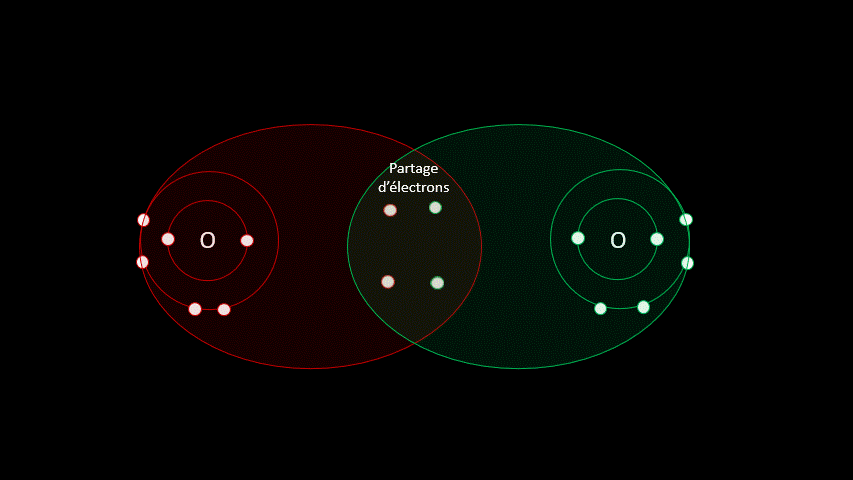
3.2 Un peu d'exercices
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer4. Synthèse
Astuce!
Tu veux réussir mieux en étudiant moins ! Prends le temps de consigner dans le cahier de notes l'ensemble de tes apprentissages. Tu auras ainsi un cahier non seulement ordonné, mais aussi imprimable. De plus, le fait de résumer, d'expliquer, de synthétiser la matière te permet de mieux l'assimiler. Ton temps d'étude en sera sans aucun doute réduit!
Important : Lorsque tu prends des notes dans ton cahier, tu dois toujours cliquer sur "enregistrer" pour les conserver. Une fois tes notes compilées, n'oublie pas de cocher la boite à côté de cette ressource afin d'avoir accès au test de validation de la station.