M2S1_RE
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
2. Les ions et la règle de l'octet
2.1 La stabilité des gaz inertes et la loi de l'octet
Regarde la vidéo ci-dessous pour apprendre un peu plus sur la règle d'octet.
Les atomes sont électriquement neutres, mais ce n’est pas le cas des ions. Ces atomes (ou ces groupes d’atomes) portent une charge électrique positive ou négative.
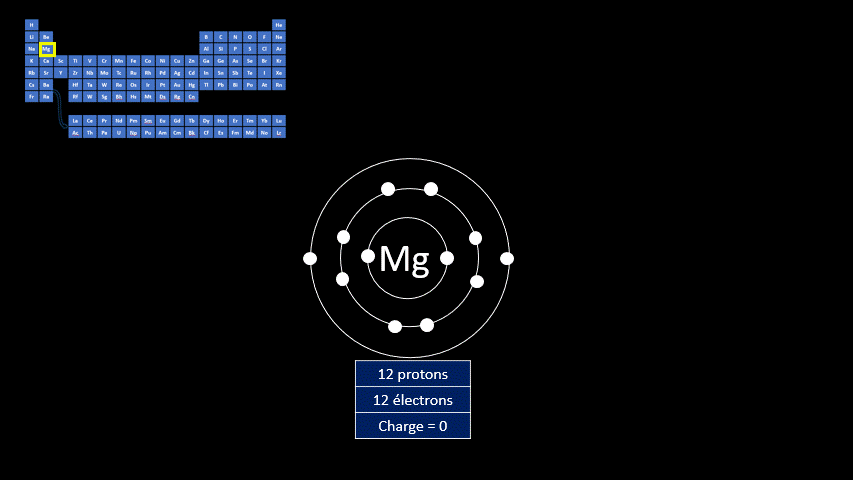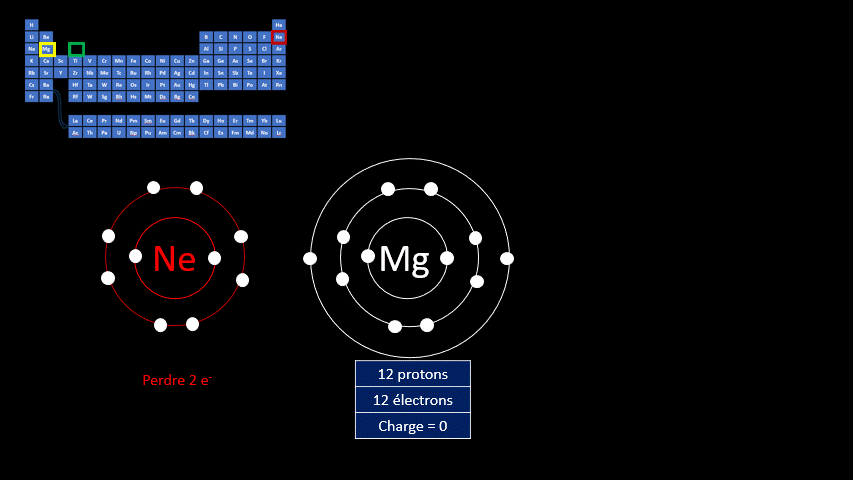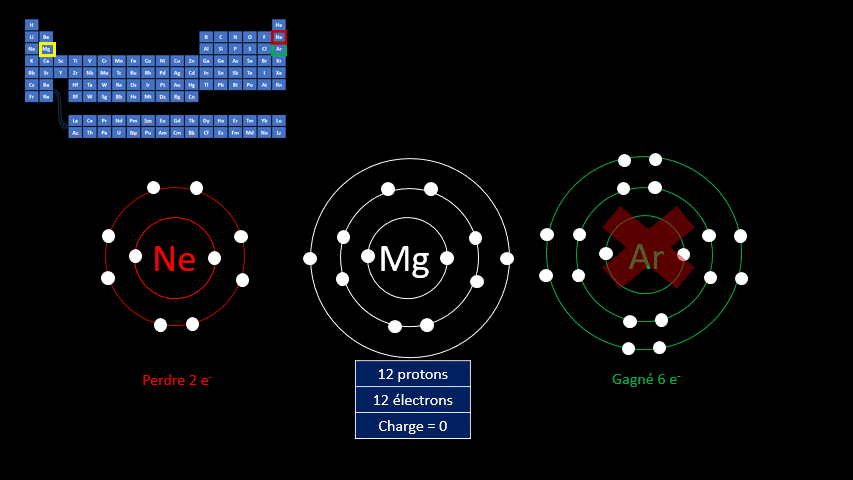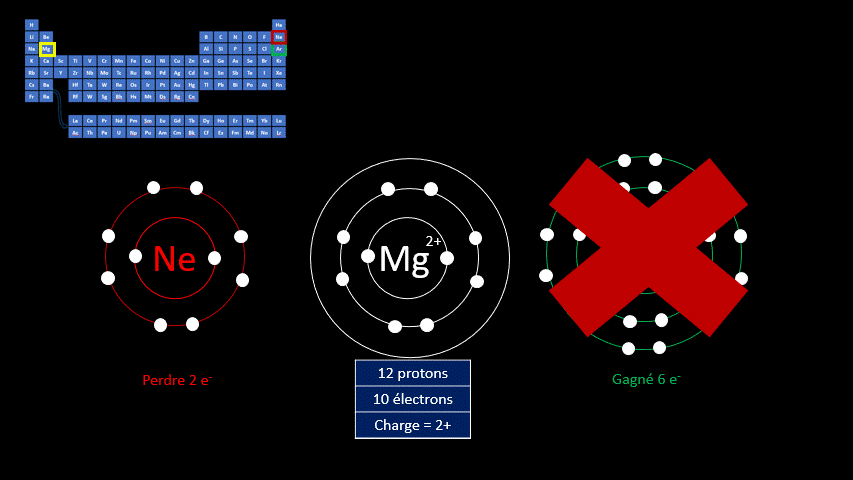
Les ions monoatomiques (mono signifie un, donc un ion n'ayant qu'un seul atome) sont formés lorsqu’un atome gagne ou perd au moins un électron. La règle de l'octet précise que tous les atomes cherchent à avoir leur dernière couche électronique complète pour être chimiquement plus stable. Pour y arriver, ils peuvent perdre ou gagner des électrons. Toutefois, en changeant leur nombre d'électrons ils ne sont plus électriquement neutres (il n'y a plus autant de protons que d'électrons). Ils ne peuvent donc plus être appelés "atomes". On doit alors les appeler "ions". Un ion est donc un atome dont la dernière couche est complète, mais dont le nombre de protons n'est pas égal au nombre d'électrons. Ils adoptent alors la configuration électronique (c’est-à-dire la répartition des électrons) propre aux gaz inertes. Les couches électroniques de ceux-ci sont pleines. Ils ont donc huit électrons de valence, à l’exception de l’hélium qui n’en a que deux.
Par exemple, le fluor a 9 protons et 9 électrons. Il serait plus stable chimiquement s’il possédait un électron supplémentaire, comme le néon qui le suit dans le tableau périodique. Lorsqu’il gagne un électron, l’atome de fluor devient l’ion F - et a la même configuration électronique que le néon. Son nombre de protons est toujours de 9, mais son nombre d’électrons s’élève à 10. Sa charge électrique globale est donc de -1 (+9 -10 = -1)
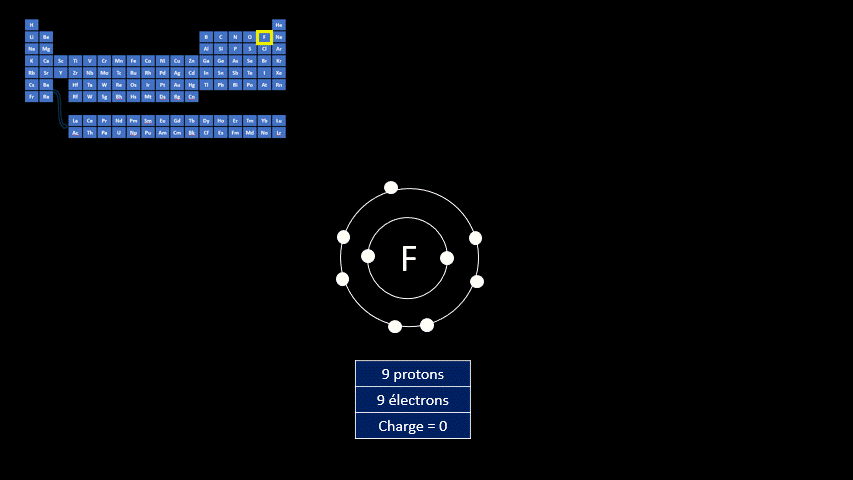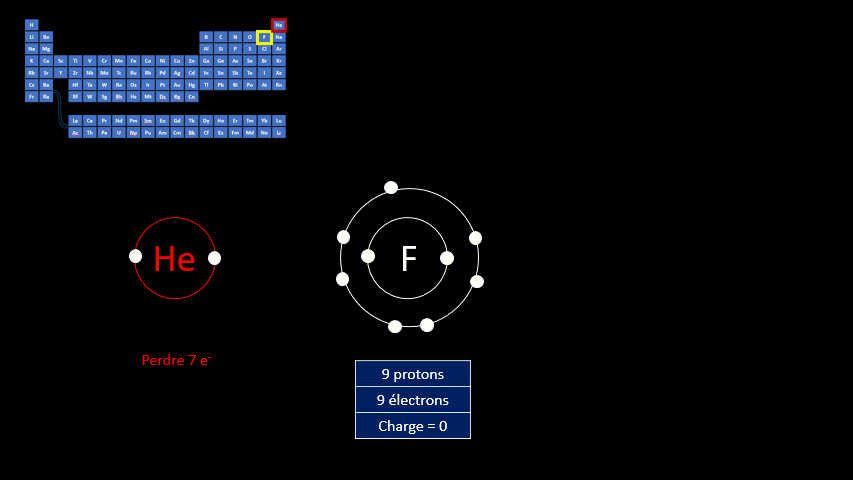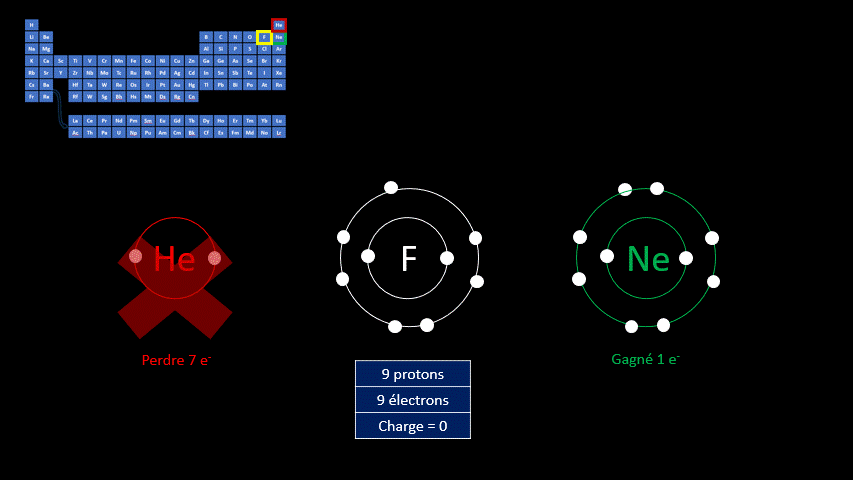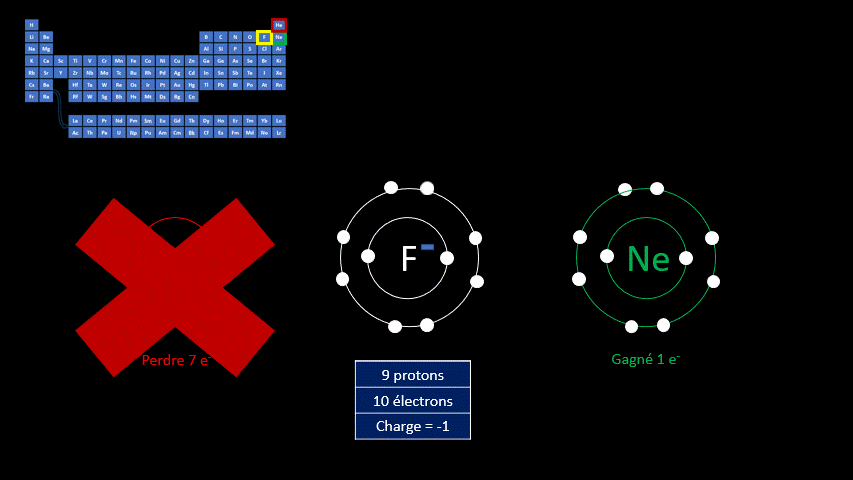
On distingue donc deux grands groupes d’ions : ceux qui portent une charge électrique négative, appelés anions, et ceux qui ont une charge positive, appelés cations. Le tableau suivant résume les caractéristiques des ions monoatomiques des deux groupes.
| # | Cation | Anion |
|---|---|---|
| Charge | Positive | Négative |
| Perte ou gain d'électron(s) | Perte | Gain |
| Famille du tableau périodique | I, IIA, IIIA | VA, VIA, VIIA |
| Exemple | Li+, Ca2+, Al3+ | F-, Se2-, P3- |
2.2 Les ions
Les élèves de ST peuvent manipuler que les protons et les électrons pour répondre aux questions.
À l'aide de la section “Construire un atome”, répondez aux questions suivantes :
Observe tes résultats. Vois-tu une tendance ? Pourrais-tu déduire la charge de l'ion brome, par exemple ?