M1S1_RE
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
5. Le modèle Rutherford-Bohr
5.1 Les ajouts de Bohr au modèle de Rutherford
Dans son modèle, Rutherford se contente de dire que les électrons tournent autour du noyau. Bohr ajoute une spécification au modèle de Rutherford. Les électrons ne tournent pas de façon chaotique, mais dans des nuages précis appelés couches électroniques (ou niveaux énergétiques). Un atome neutre possède le même nombre de protons et d'électrons. Le nombre d'électrons correspond donc aussi au numéro atomique. Voici quelques règles dictées par le modèle de Rutherford-Bohr. Avec ces informations, vous pourrez comprendre la configuration électronique des vingt premiers éléments du tableau périodique.
- Lorsque l'on place les électrons sur les différentes couches électroniques, on remplit toujours les premières couches avant de passer à la suivante.
- La première couche électronique possède un maximum de deux électrons.
- La deuxième et la troisième possèdent un maximum de huit électrons chacune.
- La dernière couche électronique n'est pas nécessairement pleine, c'est-à-dire qu'elle ne possède pas nécessairement le nombre maximal d'électrons. Ces électrons, soient ceux de la dernière couche électronique, sont appelés électrons de valence ou électrons périphériques . Ils auront une grande importance lorsqu'on parlera de stabilité chimique.
Les électrons de valence ou électrons périphériques sont ceux qui sont positionnés sur la couche électronique externe de l'atome. Ils ont une grande importance pour la suite des choses. En effet, comme nous le verrons, ce sont eux qui déterminent la stabilité chimique ou la réactivité d'un atome.

5.2 Représenter un atome selon le modèle de Rutherford-Bohr
Pour représenter un atome selon le modèle de Rutherford-Bohr, il faut s'intéresser à la fois au nombre de protons contenus dans le noyau (donné par le numéro atomique), et au nombre d'électrons (égal au nombre de protons) ainsi qu'à leur distribution sur les différentes couches électroniques.

Le béryllium
-
Déterminer le nombre de protons
Le nombre de protons est donné par le numéro atomique. Pour le béryllium, il est de 4. Le béryllium a donc 4 protons.
-
Placer les électrons sur la première couche électronique
Le numéro atomique ne donne pas seulement le nombre de protons, mais donne aussi le nombre d'électrons total de l'atome. La première couche peut contenir un maximum de 2 électrons. On ne pourra donc pas y placer les quatre électrons et cet atome nécessitera une deuxième couche électronique.
-
Placer les électrons sur la deuxième couche électronique
Comme 2 électrons ont été placés sur la première couche, il reste 2 électrons à placer sur la seconde couche électronique. Comme on n'atteint pas le nombre maximal de 8 électrons, on place les 2 électrons restants sur cette couche. L'atome de béryllium possède donc 2 électrons de valence.

L'aluminium
-
Déterminer le nombre de protons
Le nombre de protons est donné par le numéro atomique. L'aluminium possède 13 protons.
-
Placer les électrons sur la première couche électronique
L'aluminium possède aussi 13 électrons. La première couche peut contenir un maximum de 2 électrons. On ne pourra donc pas y placer les 13 électrons et cet atome nécessitera une deuxième couche électronique.
-
Placer les électrons sur la deuxième couche électronique
Comme 2 électrons ont été placés sur la première couche, il reste 11 électrons à placer sur la seconde couche électronique. Comme la deuxième couche a un maximum de 8 électrons cet atome nécessitera une troisième couche électronique.
-
Placer les électrons sur la troisième couche életctronique
Comme 10 électrons ont déjà été placés, il ne reste que 3 électrons à placer sur la troisième couche électronique. Comme celle-ci a un maximum de 8 électrons, on pourra mettre les 3 électrons restants sans problème. L'atome d'aluminium possède donc 3 électrons de valence.

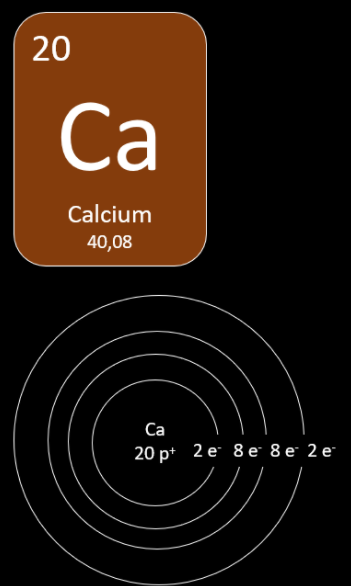
Le calcium
-
Déterminer le nombre de protons
Le nombre de protons est donné par le numéro atomique. Le calcium a donc 20 protons.
-
Placer les électrons sur la première couche électronique
Le calcium possède aussi 20 électrons. La première couche peut contenir un maximum de 2 électrons. On ne pourra donc pas y placer les 20 électrons et cet atome nécessitera une deuxième couche électronique.
-
Placer les électrons sur la deuxième couche électronique
Comme 2 électrons ont été placés sur la première couche, il reste 18 électrons à placer sur la seconde couche électronique. Comme la deuxième couche a un maximum de 8 électrons cet atome nécessitera une troisième couche électronique.
-
Placer les électrons sur la troisième couche électronique
Comme 10 électrons ont déjà été placés, il reste 10 électrons à placer sur la troisième couche électronique. Comme celle-ci a un maximum de 8 électrons cet atome nécessitera une quatrième couche électronique.
-
Placer les électrons sur la quatrième couche
Comme 18 électrons ont déjà été placés, il ne reste que 2 électrons à placer sur la quatrième couche électronique. Le nombre maximal n'ayant pas été atteint, on peut y placer ces 2 électrons sans problème. L'atome de calcium possède donc 2 électrons de valence.
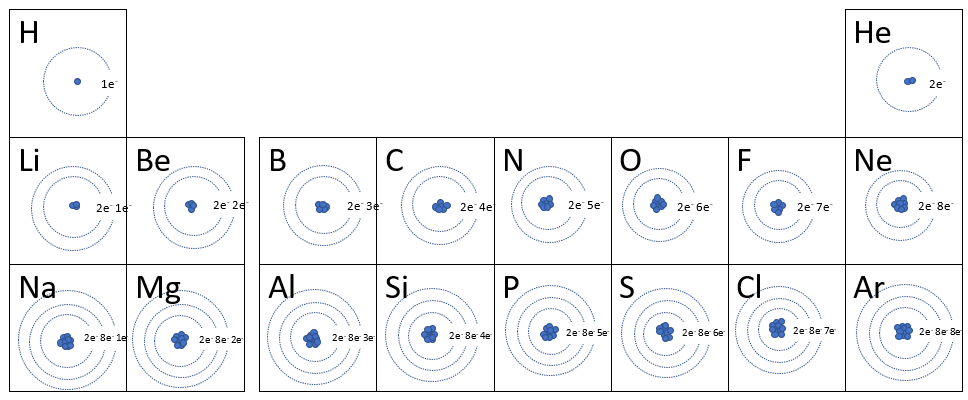
D'autres règles s'appliquent pour les éléments dont le numéro atomique est supérieur à celui du calcium (20). Nous en verrons une partie à la station 3 de ce module.
Enfin, les concepts de famille et période seront revus dans la station 3 de ce module.