M1S1_RE
| Site: | Moodle CSSRDN |
| Cours: | Science 4e secondaire (ST / STE) - 2023-2024 |
| Livre: | M1S1_RE |
| Imprimé par: | Visiteur anonyme |
| Date: | dimanche 8 mars 2026, 22:58 |
Description
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. Rappel sur l'atome
1.1 Qu'est-ce que l'atome ?
Le mot atome vient du grec atomos qui signifie indivisible. Pour comprendre de quoi il s'agit, donnons-nous un exemple. Disons que lors d'une fête, on veuille séparer une pizza selon le nombre de personnes présentes. S'il y a huit personnes, l'opération n'est pas bien difficile. Pourtant, si on imaginait que l'ensemble de la population du Québec veuille avoir sa part de la pizza, ce serait bien plus difficile et, au bout du compte, la part serait drôlement petite. Lorsque les premières conceptions de l'atome sont apparues, on s'imaginait la plus petite particule possible comme la pointe de pizza qu'on ne pouvait plus diviser.
1.2 Les débuts de la modélisation
En procédant à des expériences sur la solubilité des gaz (quantité de gaz qu'on peut dissoudre dans l'eau), Dalton ramène le concept d'atome à l'avant plan. Pour lui, l'atome est indivisible, mais il spécifie que les atomes d'éléments différents sont différents et que ceux du même élément sont identiques. Ainsi, tous les atomes d'oxygène sont selon lui identiques, et il ne peut y avoir un atome de fer qui ait la même masse qu'un atome de cuivre.

Clique sur le bouton ci-dessous pour poursuivre au prochain chapitre.
Continuer2. Les rayonnements alpha
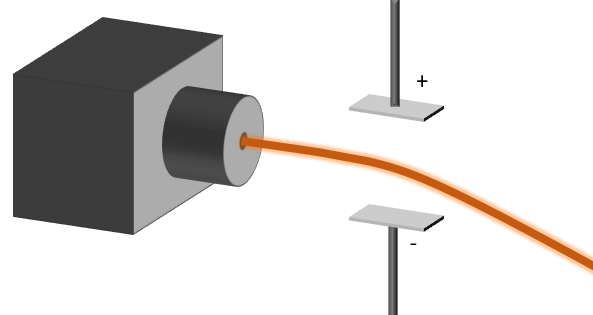
Nouvellement découverts à l'époque de Rutherford, les rayonnements émis par une substance radioactive ont éveillé une tonne de questionnements dans la communauté scientifique du début du 20e siècle. Pour mieux expliquer l'expérience de la feuille d'or, il faut comprendre la nature même de ces rayonnements. On sait que des charges de même signe se repoussent. Ainsi, une expérience très simple permet de déterminer la charge du rayonnement alpha. En faisant passer un faisceau de ces particules alpha dans un champ électrique, on peut constater que ce rayonnement est chargé en observant sa déviation.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer3. Expérience de Rutherford
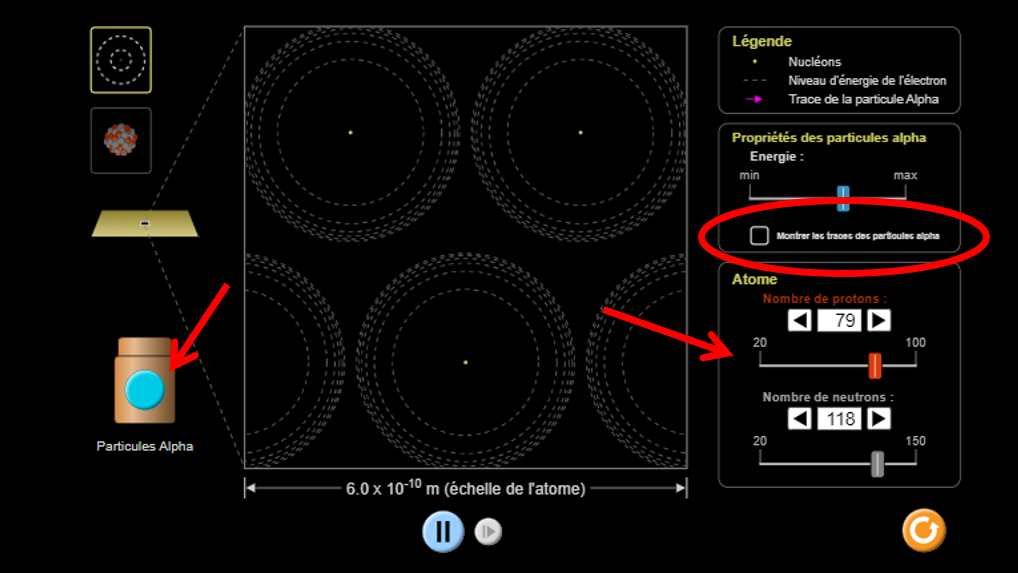
Cette simulation te permet de voir au niveau atomique ce qui se passe lorsque le faisceau de particules traverse la feuille d'or dans l'expérience de Rutherford.
Démarre la simulation en choisissant le modèle de Rutherford. Comme illustré sur l'image ci-contre, appuie sur le bouton bleu des particules alpha. Observe les résultats. Pour t'aider, il est recommandé d'activer l'option Montrer les traces des particules alpha. Tu peux aussi faire varier le nombre de protons et l'énergie des particules pour t'aider à comprendre ce qui se passe. Tu pourras ensuite noter tes observations dans la partie synthèse (section 7).
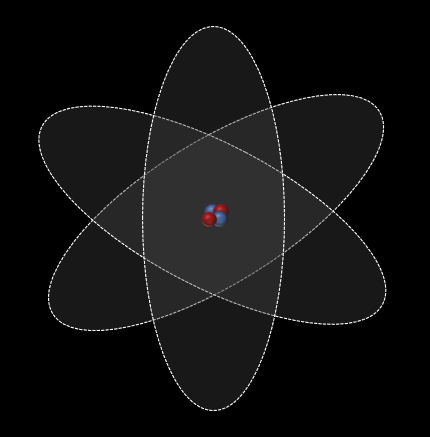
Au cours de son expérience, Rutherford envoie sur une mince feuille d'or un faisceau de particules alpha (particules positives). Le feuille d'or se voulait être si mince qu'elle aurait un seul atome d'épaisseur ! Évidement, ce n'était pas le cas, et Rutherford le savait bien, mais il voulait tout de même qu'elle soit le plus mince possible.
L'expérience de Rutherford nous permet donc d'en connaître plus au sujet de la structure de l'atome.
- L'atome possède noyau de charge positive
- Le noyau de l'atome est très petit mais possède un masse importante
- L'atome est majoritairement constitué de vide
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer4. Le proton
Le proton est une particule positive dont la masse est supérieure à celle de l'électron. En vérité, la masse de l'électron est négligeable par rapport à celle du proton. L'atome est presqu'entièrement constitué de vide. Les électrons gravitent autour d'un amas dense de protons appelé noyau. Le nombre de protons contenus dans l'atome détermine la nature de cet atome. Autrement dit, chaque type d'atome a son propre nombre de protons.
Prenons l'exemple de l'oxygène.
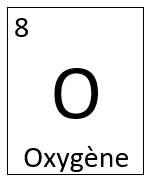
L'oxygène possède 8 protons puisque son numéro atomique est de 8, soit le chiffre indiqué sur le tableau périodique qui se trouve généralement dans la partie supérieure de la case. Nous verrons plus en détail le rôle du numéro atomique dans la section 2 de ce module.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer5. Le modèle Rutherford-Bohr
5.1 Les ajouts de Bohr au modèle de Rutherford
Dans son modèle, Rutherford se contente de dire que les électrons tournent autour du noyau. Bohr ajoute une spécification au modèle de Rutherford. Les électrons ne tournent pas de façon chaotique, mais dans des nuages précis appelés couches électroniques (ou niveaux énergétiques). Un atome neutre possède le même nombre de protons et d'électrons. Le nombre d'électrons correspond donc aussi au numéro atomique. Voici quelques règles dictées par le modèle de Rutherford-Bohr. Avec ces informations, vous pourrez comprendre la configuration électronique des vingt premiers éléments du tableau périodique.
- Lorsque l'on place les électrons sur les différentes couches électroniques, on remplit toujours les premières couches avant de passer à la suivante.
- La première couche électronique possède un maximum de deux électrons.
- La deuxième et la troisième possèdent un maximum de huit électrons chacune.
- La dernière couche électronique n'est pas nécessairement pleine, c'est-à-dire qu'elle ne possède pas nécessairement le nombre maximal d'électrons. Ces électrons, soient ceux de la dernière couche électronique, sont appelés électrons de valence ou électrons périphériques . Ils auront une grande importance lorsqu'on parlera de stabilité chimique.
Les électrons de valence ou électrons périphériques sont ceux qui sont positionnés sur la couche électronique externe de l'atome. Ils ont une grande importance pour la suite des choses. En effet, comme nous le verrons, ce sont eux qui déterminent la stabilité chimique ou la réactivité d'un atome.

5.2 Représenter un atome selon le modèle de Rutherford-Bohr
Pour représenter un atome selon le modèle de Rutherford-Bohr, il faut s'intéresser à la fois au nombre de protons contenus dans le noyau (donné par le numéro atomique), et au nombre d'électrons (égal au nombre de protons) ainsi qu'à leur distribution sur les différentes couches électroniques.

Le béryllium
-
Déterminer le nombre de protons
Le nombre de protons est donné par le numéro atomique. Pour le béryllium, il est de 4. Le béryllium a donc 4 protons.
-
Placer les électrons sur la première couche électronique
Le numéro atomique ne donne pas seulement le nombre de protons, mais donne aussi le nombre d'électrons total de l'atome. La première couche peut contenir un maximum de 2 électrons. On ne pourra donc pas y placer les quatre électrons et cet atome nécessitera une deuxième couche électronique.
-
Placer les électrons sur la deuxième couche électronique
Comme 2 électrons ont été placés sur la première couche, il reste 2 électrons à placer sur la seconde couche électronique. Comme on n'atteint pas le nombre maximal de 8 électrons, on place les 2 électrons restants sur cette couche. L'atome de béryllium possède donc 2 électrons de valence.

L'aluminium
-
Déterminer le nombre de protons
Le nombre de protons est donné par le numéro atomique. L'aluminium possède 13 protons.
-
Placer les électrons sur la première couche électronique
L'aluminium possède aussi 13 électrons. La première couche peut contenir un maximum de 2 électrons. On ne pourra donc pas y placer les 13 électrons et cet atome nécessitera une deuxième couche électronique.
-
Placer les électrons sur la deuxième couche électronique
Comme 2 électrons ont été placés sur la première couche, il reste 11 électrons à placer sur la seconde couche électronique. Comme la deuxième couche a un maximum de 8 électrons cet atome nécessitera une troisième couche électronique.
-
Placer les électrons sur la troisième couche életctronique
Comme 10 électrons ont déjà été placés, il ne reste que 3 électrons à placer sur la troisième couche électronique. Comme celle-ci a un maximum de 8 électrons, on pourra mettre les 3 électrons restants sans problème. L'atome d'aluminium possède donc 3 électrons de valence.

Le calcium
-
Déterminer le nombre de protons
Le nombre de protons est donné par le numéro atomique. Le calcium a donc 20 protons.
-
Placer les électrons sur la première couche électronique
Le calcium possède aussi 20 électrons. La première couche peut contenir un maximum de 2 électrons. On ne pourra donc pas y placer les 20 électrons et cet atome nécessitera une deuxième couche électronique.
-
Placer les électrons sur la deuxième couche électronique
Comme 2 électrons ont été placés sur la première couche, il reste 18 électrons à placer sur la seconde couche électronique. Comme la deuxième couche a un maximum de 8 électrons cet atome nécessitera une troisième couche électronique.
-
Placer les électrons sur la troisième couche électronique
Comme 10 électrons ont déjà été placés, il reste 10 électrons à placer sur la troisième couche électronique. Comme celle-ci a un maximum de 8 électrons cet atome nécessitera une quatrième couche électronique.
-
Placer les électrons sur la quatrième couche
Comme 18 électrons ont déjà été placés, il ne reste que 2 électrons à placer sur la quatrième couche électronique. Le nombre maximal n'ayant pas été atteint, on peut y placer ces 2 électrons sans problème. L'atome de calcium possède donc 2 électrons de valence.
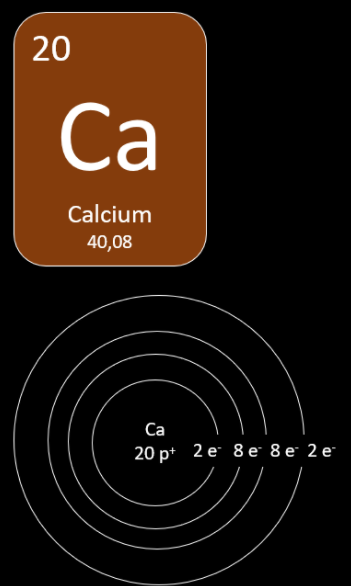
D'autres règles s'appliquent pour les éléments dont le numéro atomique est supérieur à celui du calcium (20). Nous en verrons une partie à la station 3 de ce module.
Enfin, les concepts de famille et période seront revus dans la station 3 de ce module.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer6. Tableau périodique et numéro atomique
6.1 Ce que l'on retrouve dans le tableau périodique
Voici l’exemple d’une case du tableau périodique avec les informations qu’elle contient.

En observant la case de l’élément représentant le lithium, tu peux remarquer un nombre entier et un nombre décimal. Nous nous attarderons davantage sur le nombre entier soit le chiffre 3. Lorsqu’on veut représenter un élément à l'aide du modèle atomique de Rutherford-Bohr, on doit se servir du nombre entier qui correspond au numéro atomique de l’atome.
6.2 Modèle de Rutherford-Bohr
Pour représenter un atome selon le modèle de Rutherford-Bohr (modèle atomique simplifié), il est nécessaire de regarder où se situe cet élément dans le tableau périodique. Dans l’exemple du Lithium, ce dernier est situé sur la 2e période (rangée) ce qui signifie qu’il possède donc deux couches électroniques. Dans les ressources précédentes de la station 1, on a vu que la première couche électronique ne peut contenir plus de 2 électrons. On placerait donc 2 électrons sur cette première couche électronique du Li. Étant donné que le Lithium appartient à la famille I (colonne 1), il possède un électron de valence (un électron sur sa dernière couche électronique). Voici la configuration électronique du Lithium.
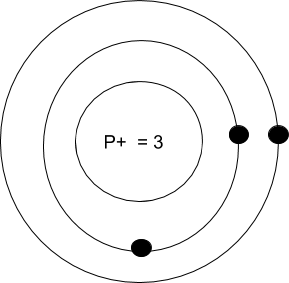
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer7. Synthèse
Astuce!
Tu veux réussir mieux en étudiant moins ! Prends le temps de consigner dans le cahier de notes l'ensemble de tes apprentissages. Tu auras ainsi un cahier non seulement ordonné, mais aussi imprimable. De plus, le fait de résumer, d'expliquer, de synthétiser la matière te permet de mieux l'assimiler. Ton temps d'étude en sera sans aucun doute réduit!
Important : Lorsque tu prends des notes dans ton cahier, tu dois toujours cliquer sur "enregistrer" pour les conserver. Une fois tes notes compilées, n'oublie pas de cocher la boite à côté de cette ressource afin d'avoir accès au test de validation de la station.