M5S1_RE
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. Qu'est-ce qu'un isotope ?
1.1 Définition
Si le modèle atomique de Dalton suppose que chaque atome d'un même élément possède la même masse, les études postérieures à Dalton ont prouvé que ce n'est pas tout à fait le cas. Par exemple, le carbone se retrouve dans la nature sous deux formes principalement, soit le carbone 12 et le carbone 13. Pourtant, une troisième forme du carbone, le carbone 14, a une importance capitale en paléontologie, et ce, même si on n'en retrouve que très peu dans la nature. C'est grâce à cet isotope notamment qu'on a pu dater les peintures du site rupestre de Nisula dans la région de la Côte-Nord, ici même au Québec.
Le carbone 12, le carbone 13 et le carbone 14 sont en fait trois isotopes du carbone. Ils ont des masses atomiques différentes de celle qui est présentée dans le tableau périodique. Il en est de même pour la plupart des éléments. Des isotopes, ce sont donc des éléments qui ont le même nombre de protons, mais un nombre différent de neutrons dans leur noyau. Ainsi, leur masse diffère, mais leur nature et leur réactivité chimique est exactement la même. Ils ont le même symbole, le même numéro atomique (nombre Z), mais comme le nombre de neutrons est différent, ils n'ont pas le même nombre de masse (nombre A).
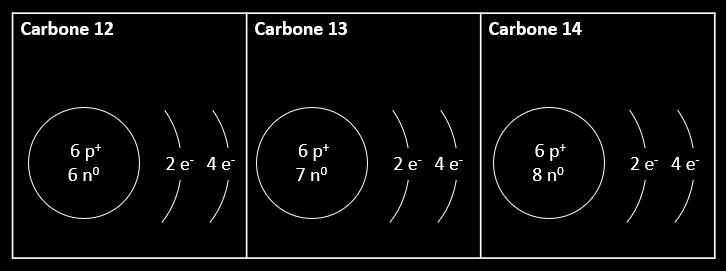
Les nucléons, ce sont les particules qui se retrouvent dans le noyau atomique. C'est le nombre de nucléons (somme des protons et des neutrons) que l'on utilise pour désigner un isotope. Ainsi, le carbone 12 possède 12 nucléons. Comme 6 d'entre eux sont des protons, on peut déduire qu'il possède 6 neutrons. Le carbone 14 a quant à lui 8 neutrons. Ce nombre est appelé nombre de masse d'un isotope. On peut aussi désigner un isotope sous la forme \( {^{A}_{Z}X} \).
\( {^{12}_{6}C} \) |
\( {^{13}_{6}C} \) | \( {^{14}_{6}C} \) |
|---|
Pour obtenir le nombre de neutrons, on soustrait le numéro atomique (Z) du nombre de masse (A).
Dans le premier isotope,
si on effectue cette soustraction, on obtiendra 12 nucléons - 6 protons = 6 neutrons.
Dans le deuxième isotope,
si on effectue cette soustraction, on obtiendra 14 nucléons - 6
protons = 8 neutrons.
Comme ils ont le même nombre de protons, les
isotopes sont de même nature. Comme ils ont le même nombre d’électrons, ils ont
la même réactivité chimique. Qu’est-ce qui diffère entre deux isotopes ? La
vérité, c’est que la plupart du temps, ça ne change pas tant de choses, mis-à-part
le fait que l’un sera plus lourd que l’autre. Cependant, dans certains cas, l’isotope
est radioactif et, comme tu peux t'en douter, la différence devient
capitale.
Un isotope radioactif est composé d’un noyau
instable qui se brisera de façon spontanée (radioactivité naturelle) ou de
façon provoquée (radioactivité artificielle). Il est important de mentionner
que lorsqu’on parle d’un isotope au noyau instable, on entend par cela, un
noyau qui se désintègre en émettant des particules nucléaires ou des photons.
Cela survient avec un isotope dont le noyau a une force de répulsion de ses
protons qui est supérieure à la force nucléaire. En d’autres mots, les neutrons
sont incapables de conserver la stabilité du noyau et la force de répulsion
des protons fait éclater le noyau. Tu verras cette
notion plus en détails dans la station 2.