M1S5_RE
| Site: | Moodle CSSRDN |
| Cours: | Science 4e secondaire (ST / STE) - 2023-2024 |
| Livre: | M1S5_RE |
| Imprimé par: | Guest user |
| Date: | lundi 9 mars 2026, 01:41 |
Description
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
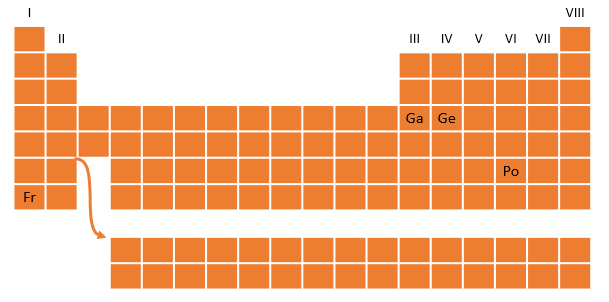
1. L'importance des électrons de valence
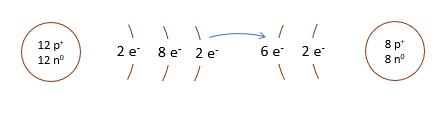
Commençons par définir ce qu'est un électron de valence. En vérité, il s'agit d'un électron périphérique ou, si tu préfères, un électron sur la dernière couche électronique. Comme ce sont les électrons les plus éloignés du noyau, ce sont aussi ceux qui sont les moins attirés par celui-ci. Ils constituent donc les particules qui participeront à l'ensemble des réactions chimiques. Ce sont aussi eux qui formeront les liens entre les atomes dans les regroupements d'atomes appelés molécules. Ces électrons ont donc un rôle primordial à jouer dans la stabilité ou la réactivité chimique d'un atome.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer2. La notation de Lewis
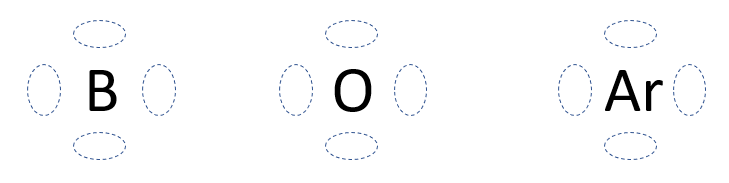
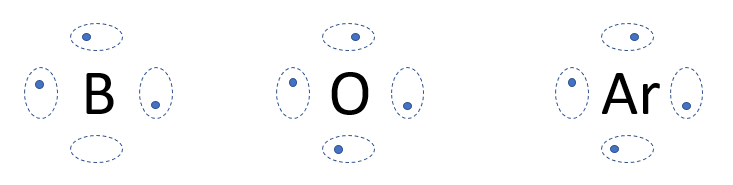
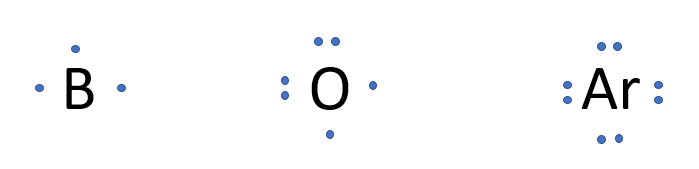
Lewis propose donc une représentation de l'atome qui ne tient compte que des électrons de valence. Cette notation sera essentielle lorsque nous expliquerons comment se forment les liaisons chimiques dans les molécules. Voici donc les grandes règles à suivre pour représenter un élément selon cette notation.

Gilbert N Lewis
Né en 1877 au Massachusetts et mort en 1946 à Berkeley en Californie, Gilbert Lewis a été nommé 41 fois pour le prix Nobel de chimie pour ses travaux en thermodynamique, mais ne l'a jamais obtenu. Il aurait été en mauvais termes avec un ancien collaborateur, Walther Nernst, qui était aussi membre du comité de chimie du prix Nobel. Il a entre autres étudié les acides et les bases et les liaisons chimiques dites de valence.
3. L'hydrogène, l'hélium et les autres
Lorsque l'on représente la notation de Lewis pour les éléments qui ne possèdent qu'une seule couche électronique, soient l'hydrogène et l'hélium, il ne faut pas oublier qu'ils ne possèderont jamais plus de deux électrons. Leur notation est donc un peu particulière puisque, pour ces éléments, un seul groupe sera présent.

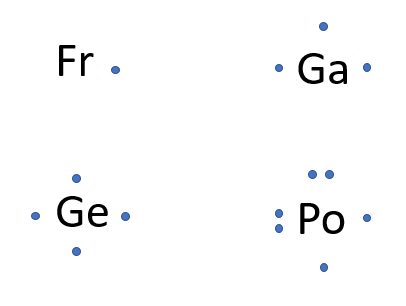
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer4. Synthèse
Astuce!
Tu veux réussir mieux en étudiant moins ! Prends le temps de consigner dans le cahier de notes l'ensemble de tes apprentissages. Tu auras ainsi un cahier non seulement ordonné, mais aussi imprimable. De plus, le fait de résumer, d'expliquer, de synthétiser la matière te permet de mieux l'assimiler. Ton temps d'étude en sera sans aucun doute réduit!
Important : Lorsque tu prends des notes dans ton cahier, tu dois toujours cliquer sur "enregistrer" pour les conserver. Une fois tes notes compilées, n'oublie pas de cocher la boite à côté de cette ressource afin d'avoir accès au test de validation de la station.