M1S3_RE
| Site: | Moodle CSSRDN |
| Course: | Science 4e secondaire (ST / STE) - 2023-2024 |
| Book: | M1S3_RE |
| Printed by: | Visiteur anonyme |
| Date: | Monday, 9 March 2026, 1:42 AM |
Description
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. Les périodes
1.1 La nécessité de classer
Du temps de Mendeleïev, on peine à classer les éléments découverts. En effet, le début des années 1900 a été une période faste en découvertes de nouveaux éléments. Quel est donc le classement ultime permettant de comprendre la matière et de répertorier de façon simple et efficace les différents éléments? Rappelons qu'à cette époque, Thomson n'avait pas découvert l'électron, Rutherford n'avait pas découvert le proton, on était loin des couches électroniques et des électrons de valence et plusieurs éléments restaient encore à découvrir.

Dimitri Ivanovich Mendeleïev
Né en 1834 à Tobolsk et mort en 1907 à Saint-Petersbourg, Mendeleïev est un chimiste russe connu pour avoir été l'artisan principal du tableau périodique des éléments. Il publie son tableau en 1869. À l'époque, sa confiance en sa classification est si grande qu'il laisse des trous là où elle ne fonctionne pas pour les éléments qui, selon lui, n'ont simplement pas été découverts... et le tableau a bel et bien été complété par des éléments jusqu'alors inconnus ! Pour la petite histoire, il n'a jamais gagné le prix Nobel de chimie, et ce, malgré sa grande contribution au domaine.
1.2 Les propriétés chimiques qui reviennent périodiquement
Dans la vidéo suivante, vous verrez comment réunir le classement par la masse et celui par les propriétés chimiques.
1.3 Les périodes
Une ligne du tableau périodique des éléments est donc une période, et cette période compte un élément de chaque famille de la même manière que l'on peut dire qu'une semaine compte une fois chaque jour de la semaine.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer2. Les familles chimiques
2.1 Les caractéristiques
Chaque élément du tableau périodique possède des caractéristiques qui lui sont propres. Certaines propriétés chimiques sont dites quantitatives, c'est-à-dire qu'on peut leur accorder une valeur. C'est le cas de la température de fusion (solide vers liquide) et celle d'ébullition (liquide vers gaz) ou des conductibilités électrique et thermique. D'autres sont sont dites qualitatives (ne peuvent être quantifiées). C'est le cas de l'éclat, de la réactivité chimique, de la malléabilité ou de la ductilité. Vous avez vu au cours des années antérieures que certaines propriétés sont caractéristiques (masse volumique, température de fusion) alors que d'autres ne l'était pas (couleur, forme, état). Une propriété est dite caractéristique lorsqu'elle permet d'identifier un élément ou une famille d'éléments chimiques.
| Propriétés |
|---|
1. Conductibilité électrique 2. Conductibilité thermique 3. Malléabilité 4. Ductilité 5. Stabilité/réactivité chimique |
2.2 Les grandes familles
Les familles sont situées dans les colonnes du tableau périodique des éléments. Chaque famille partage les mêmes propriétés chimiques. C'est ce qui définit une famille. Dans le cadre de ce cours, nous étudierons seulement les familles mises en couleur dans l'image ci-dessous. En effet, nous n'étudierons pas les éléments de transition. Les numéros de famille iront donc de 1 à 8 en sautant par-dessus les éléments de transition. Il existe quatre grandes familles qui sont énumérées dans le tableau ci-dessous.
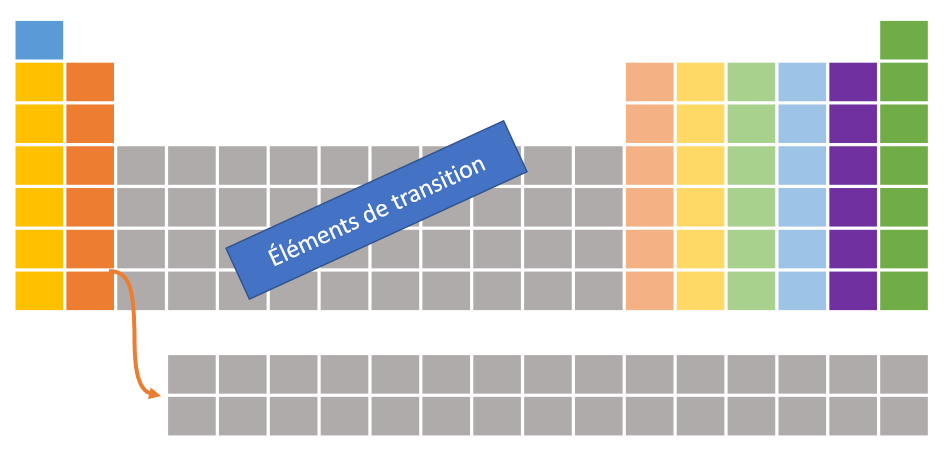
| Famille | Caractéristiques | Représentation |
|---|---|---|
| Alcalins Famille IA (1) | 1. Très bon conducteur électrique 2. Très bon conducteur thermique 3. Métal mou et malléable 4. Ductile 5. Très grande réactivité | 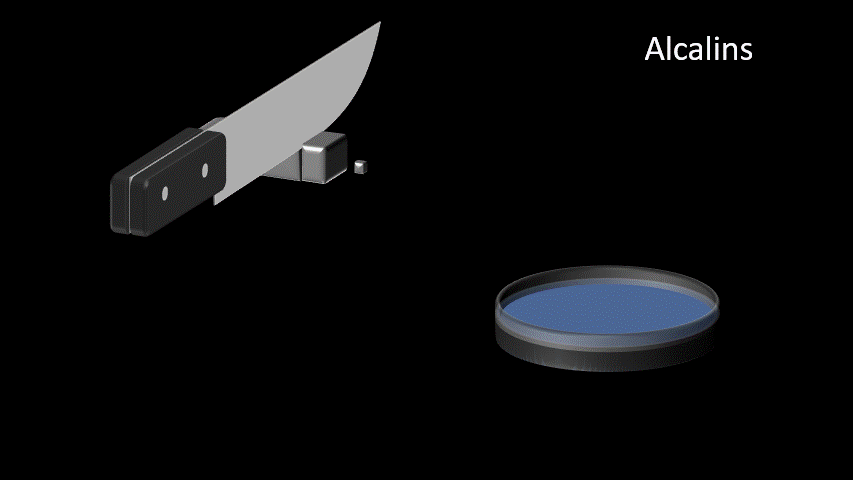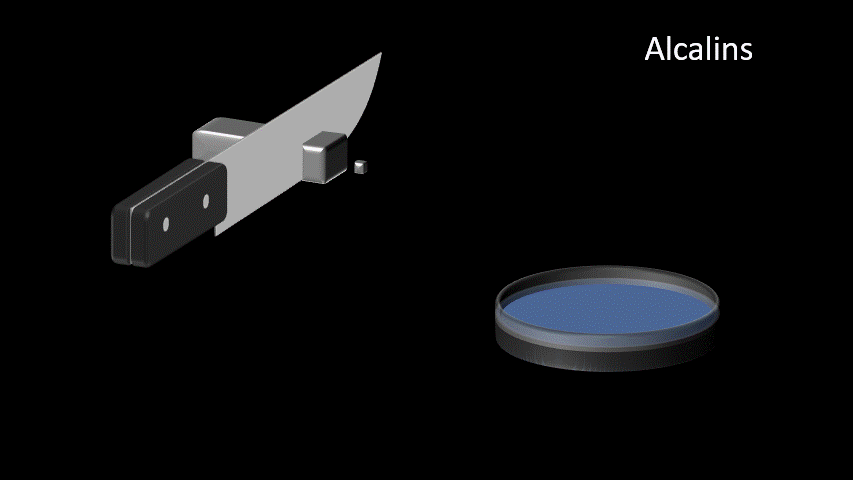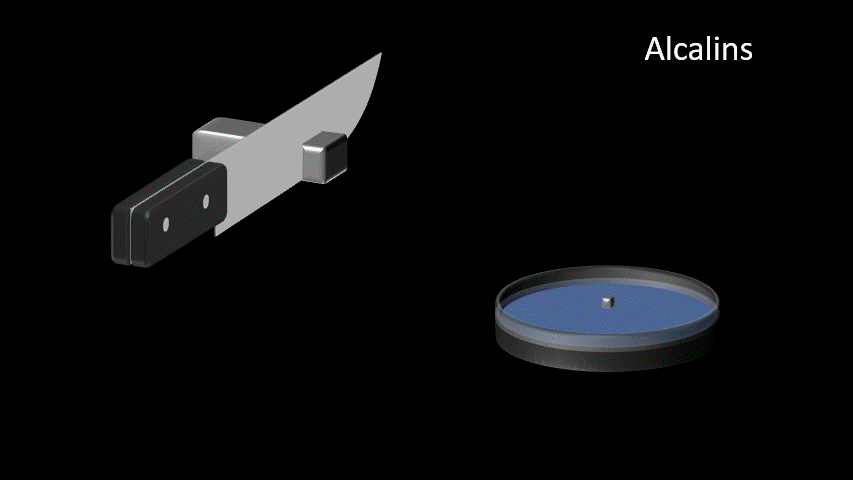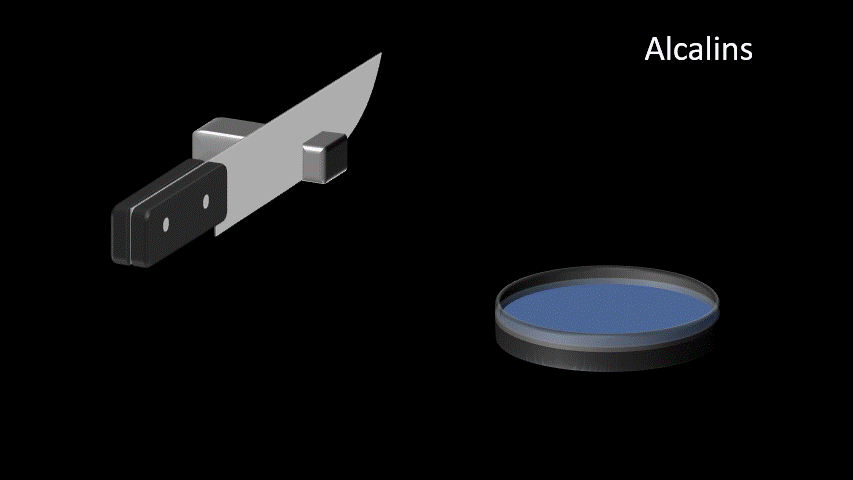 |
| Alcalino-terreux Famille IIA (2) | 1. Bon conducteur électrique 2. Bon conducteur thermique 3. Métal relativement mou et malléable 4. Ductile 5. Grande réactivité | |
| Halogènes Famille VIIA (7) | 1. Mauvais conducteur électrique 2. Mauvais conducteur thermique 3. Non-métal, non malléable 4. Non-ductile 5. Très grande réactivité | |
| Gaz inertes (gaz nobles) Famille VIIIA (8) | 1. Isolant électrique 2. Mauvais conducteur thermique 3. Non-métal, non malléable, gazeux 4. Non-ductile, gazeux 5. Très grande stabilité chimique |  |
Tu trouveras dans ce tableau périodique des éléments des images de chacun des éléments.
Pour les autres éléments du tableau périodique, on se réfère au premier élément de la famille. Par exemple, le sélénium (Se) fait partie de la famille de l'oxygène (O) et l'or (Au) fait partie de la famille du cuivre (Cu).
2.3 Explications
Dans la première station de ce module, il t'a été demandé d'étudier la représentation de la configuration électronique des 20 premiers éléments du tableau périodique. En voici un tableau :
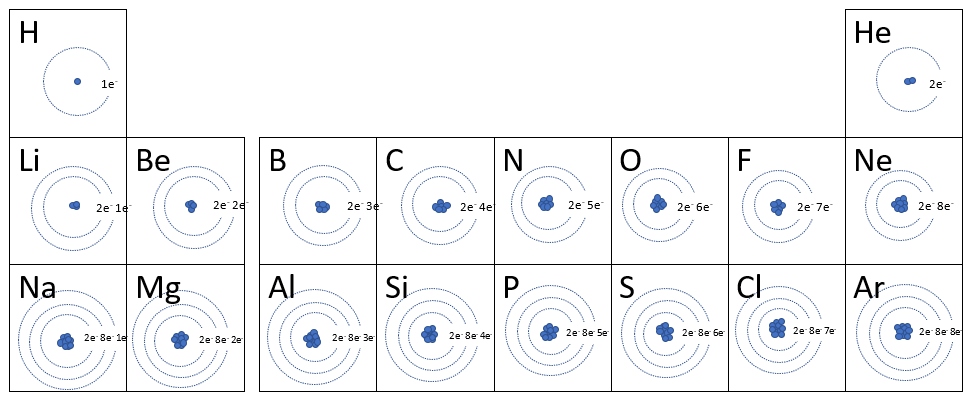
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer3. Les métaux, les non métaux et les métalloïdes
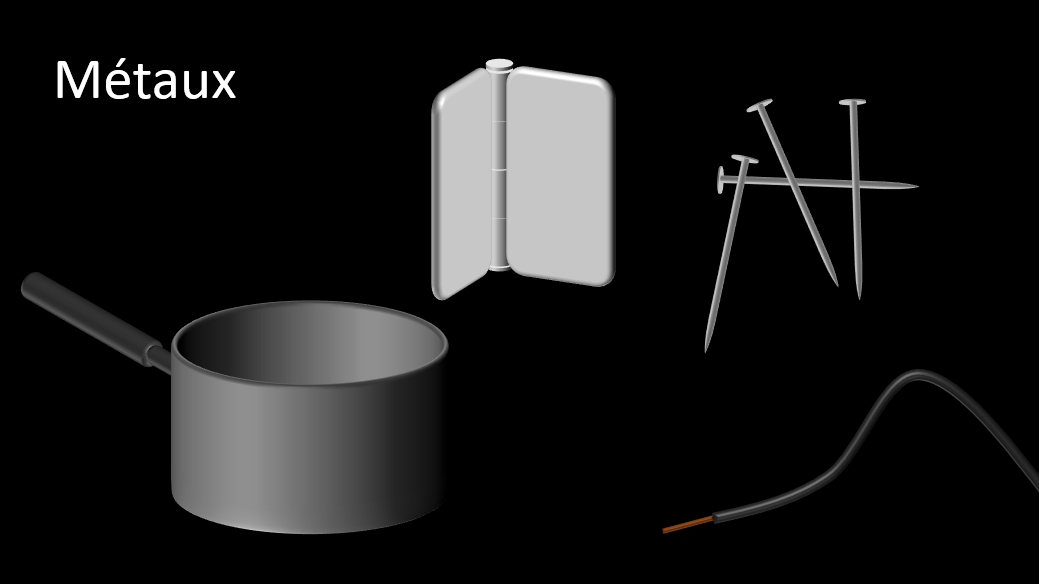
Le tableau périodique des éléments se divise en trois grands regroupements séparés par l'escalier du tableau périodique, soient les métaux, les non-métaux et les métalloïdes.
- Conducteurs thermiques et électriques
- Éclat brillant
- Malléables, c'est-à-dire qu'ils peuvent être déformés et garder la forme acquise.
- Ductiles, c'est-à-dire qu'on peut les plier, les déformer, les étirer sans les briser.
- Isolants thermiques et électriques
- Éclat terne
- Non-malléable
- Non-ductile

Voici un tableau périodique illustrant l'emplacement des métaux (région en bleu), non-métaux (région en orange) et métalloïdes (région en vert).
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer4. Synthèse
Astuce!
Tu veux réussir mieux en étudiant moins ! Prends le temps de consigner dans le cahier de notes l'ensemble de tes apprentissages. Tu auras ainsi un cahier non seulement ordonné, mais aussi imprimable. De plus, le fait de résumer, d'expliquer, de synthétiser la matière te permet de mieux l'assimiler. Ton temps d'étude en sera sans aucun doute réduit!
Important : Lorsque tu prends des notes dans ton cahier, tu dois toujours cliquer sur "enregistrer" pour les conserver. Une fois tes notes compilées, n'oublie pas de cocher la boite à côté de cette ressource afin d'avoir accès au test de validation de la station.