M1S2_RE
| Site: | Moodle CSSRDN |
| Cours: | Science 4e secondaire (ST / STE) - 2023-2024 |
| Livre: | M1S2_RE |
| Imprimé par: | Visiteur anonyme |
| Date: | dimanche 8 mars 2026, 22:58 |
Description
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. Attraction et répulsion
1.1 Retour sur les particules
Nous avons vu précédemment que, selon le modèle de Rutherford, l'atome était constitué de particules positives, les protons, et de particules négatives, les électrons. Les protons sont regroupés au centre de l'atome, dans un amas dense qu'on appelle noyau. Les électrons gravitent autour de ceux-ci à une certaine distance. L'atome est donc en grande partie constitué de vide.
Les expériences de Niels Bohr ont permis de découvrir que les électrons se situent sur des couches électroniques précises. Chaque couche représente un niveau énergétique précis. Lorsque l'on place les électrons sur les différentes couches électroniques, on commence toujours par remplir la plus petite (la plus près du noyau,) avant de remplir la suivante. La première couche électronique contient un maximum de 2 électrons. La deuxième contient un maximum de 8 électrons. Dans la section suivante, vous verrez quelques règles supplémentaires pour déterminer la configuration électronique d'autres éléments.

Ernest Rutherford
Ernest Rutherford est né en 1871 à Brightwater en Nouvelle-Zélande et est mort en 1937 à Cambridge en Angleterre. Il a reçu le prix Nobel de chimie en 1908. Il a été l'élève de Joseph John Thomson. Pour la petite histoire, Rutherford a enseigné à l'Université McGill de Montréal de 1898 à 1907.

Niels Bohr
Niels Bohr est né en 1885 et est mort en 1962 à Copenhague. Il a reçu le prix Nobel de physique de 1922. Il a entre autres travaillé avec Joseph John Thomson et Ernest Rutherford. Il est l'un des pères de la mécanique quantique. Devenu professeur, il a entre autre enseigné à Werner Heisenberg et Wolfgang Pauli, deux futurs prix Nobel de physique. Il a contribué au Projet Manhattan après avoir fui le Danemark occupé, projet qui a mené à l'invention de la première bombe atomique. Son fils, Aage Bohr, a lui aussi reçu le prix Nobel de physique en 1975.
1.2 Attraction et répulsion
Petite expérience à faire à la maison :
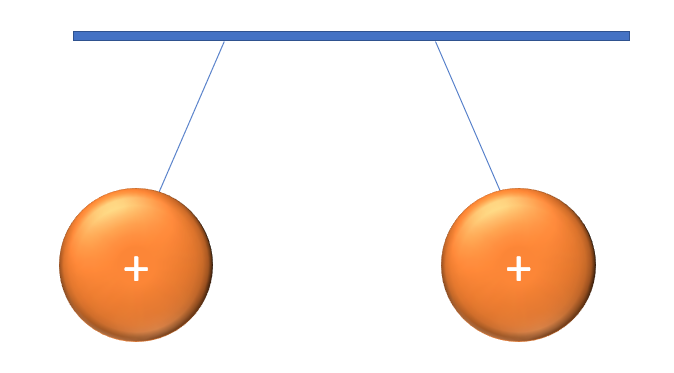
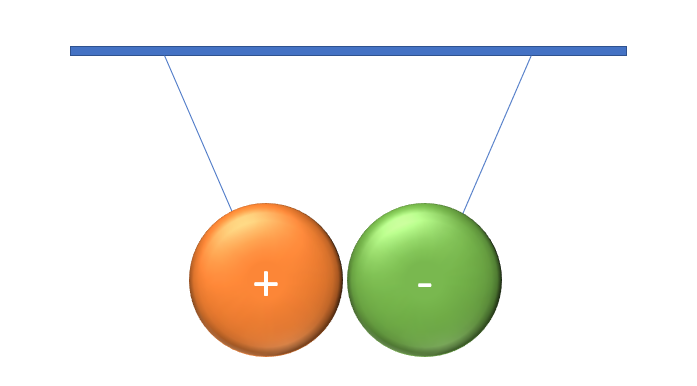
Prends une règle de plastique et frotte-la contre une étoffe de laine ou un morceau de feutre, puis approche-la doucement d'un mince filet d'eau du robinet. Tu remarqueras que le filet dévie de sa trajectoire. Il en est ainsi puisque la règle est chargée d'électrons (la laine (ou le feutre) a donné des électrons à la règle). C'est ce qu'on appelle l'électricité statique. Or, cette même règle attire les charges positives contenues dans l'eau. Observe les images suivantes pour voir ce qu'il en est.

1.3 Et le noyau
Pourtant, une question importante se pose : si les charges de même signe se repoussent, comment les protons, tous positifs, peuvent-ils demeurer regroupés dans un noyau dense au centre de l'atome? Ce noyau ne devrait-il pas éclater ?
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer2. Le neutron
2.1 Ah ! Ce neutron

James Chadwick
Né en 1891 à Manchester et mort en 1974 à Cambridge, récipiendaire du prix Nobel de physique en 1935, James Chadwick voulait d'abord s'inscrire en mathématiques à l'Université de Manchester. Inscrit par erreur à une majeure en physique et trop gêné pour en sortir, il découvrira le neutron en 1932. Dans les années '40, il passe quelques temps aux États-Unis où il contribue au projet Manhattan (bombe atomique).
3. Le modèle atomique simplifié
3.1 Les protons et la nature de l'atome
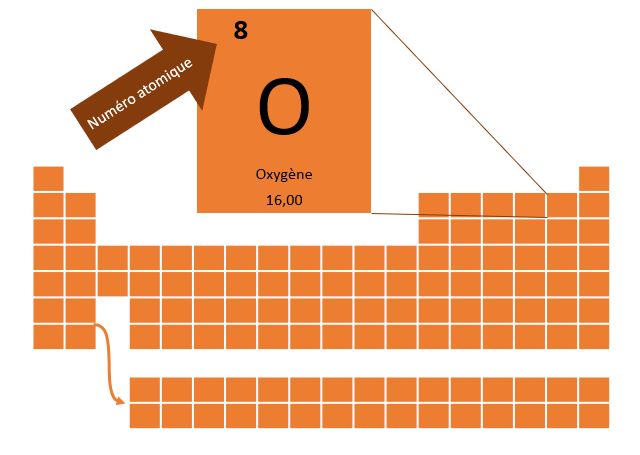
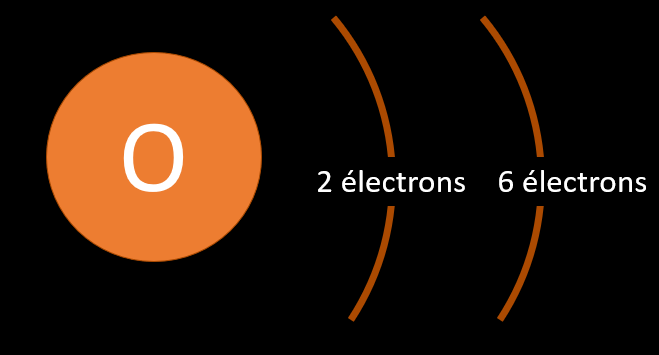
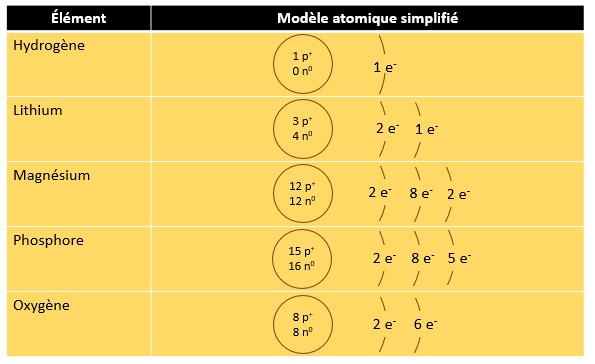
Pour aider à représenter un atome à l'exemple du modèle atomique simplifié, il faut d'abord savoir de quel atome on parle. La nature d'un élément, c'est-à-dire la sorte d'atome, comme l'oxygène ou le soufre par exemple, est déterminé par le nombre de proton qu'il possède. Par exemple, l'oxygène à 8 protons, l'hydrogène en un seul et l'uranium en a 92. On peut retrouver le nombre de protons que possède un atome en consultant son numéro atomique qu'on retrouve dans le tableau périodique des éléments.
3.2 Les neutrons et la masse atomique
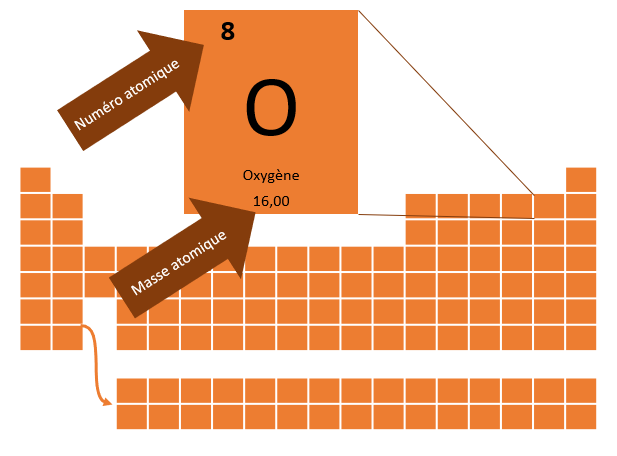
Le second nombre inscrit dans le tableau périodique est la masse atomique. Elle correspond au nombre de nucléons (particules dans le noyau de l'atome), puisque la masse de l'électron est négligeable par rapport à la masse totale de l'atome. Ce serait comme parler de l'influence de la masse d'un cheveu sur votre masse totale. Se raser la tête avant de monter sur la balance ne changera pas vraiment la masse affichée.
La masse atomique est exprimée en unités atomiques. Comme on peut s'en douter, la masse d'un atome est infiniment petite et le gramme serait une unité trop grande pour cette mesure. Ce serait comme si on mesurait le rayon d'une mine de crayon en kilomètres. 1 unité atomique correspond à 9,11 x 10 -31 kg.
Formule
Nombre de neutrons = Masse atomique - Numéro atomique
Dans le cas de l'oxygène, il y a donc 8 neutrons (16 - 8 = 8). Attention ! S'il est vrai que pour les éléments les plus légers, le nombre de protons et le nombre de neutrons sont parfois identiques, ce n'est pas toujours le cas. Le lithium (Li) par exemple a 3 protons et 4 neutrons.
3.3 Les électrons et les canapés électroniques
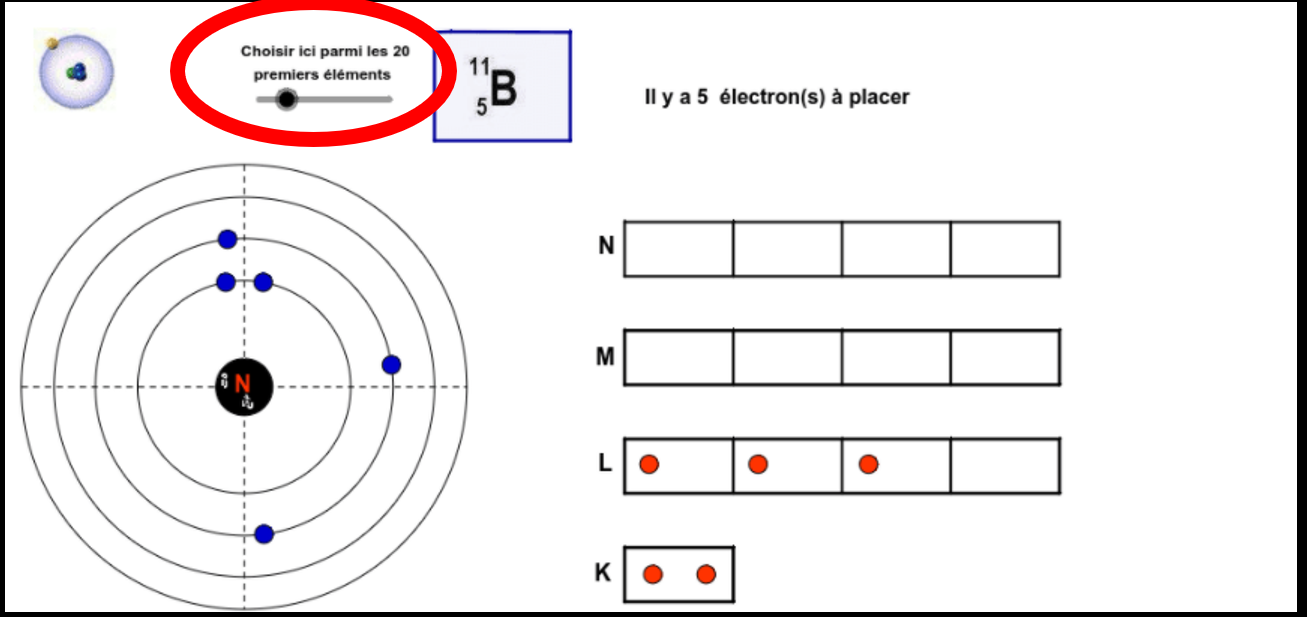
Configuration électronique des 20 premiers éléments
3.4 Le modèle atomique simplifié

3.5 Petit récapitulatif vidéo
Tu peux sélectionner ton accompagnateur en cliquant sur les photos au bas de l'image. Cette vidéo comporte plusieurs sections. Tu pourras naviguer entre les sections avec les boutons de navigation au bas de la vidéo.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer
4. Synthèse
Astuce!
Tu veux réussir mieux en étudiant moins ! Prends le temps de consigner dans le cahier de notes l'ensemble de tes apprentissages. Tu auras ainsi un cahier non seulement ordonné, mais aussi imprimable. De plus, le fait de résumer, d'expliquer, de synthétiser la matière te permet de mieux l'assimiler. Ton temps d'étude en sera sans aucun doute réduit!
Important : Lorsque tu prends des notes dans ton cahier, tu dois toujours cliquer sur "enregistrer" pour les conserver. Une fois tes notes compilées, n'oublie pas de cocher la boite à côté de cette ressource afin d'avoir accès au test de validation de la station.