M5S1_RE
| Site: | Moodle CSSRDN |
| Cours: | Science 4e secondaire (ST / STE) - 2023-2024 - Douance |
| Livre: | M5S1_RE |
| Imprimé par: | Visiteur anonyme |
| Date: | vendredi 16 janvier 2026, 19:48 |
Description
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. Qu'est-ce qu'un isotope ?
1.1 Définition
Si le modèle atomique de Dalton suppose que chaque atome d'un même élément possède la même masse, les études postérieures à Dalton ont prouvé que ce n'est pas tout à fait le cas. Par exemple, le carbone se retrouve dans la nature sous deux formes principalement, soit le carbone 12 et le carbone 13. Pourtant, une troisième forme du carbone, le carbone 14, a une importance capitale en paléontologie, et ce, même si on n'en retrouve que très peu dans la nature. C'est grâce à cet isotope notamment qu'on a pu dater les peintures du site rupestre de Nisula dans la région de la Côte-Nord, ici même au Québec.
Le carbone 12, le carbone 13 et le carbone 14 sont en fait trois isotopes du carbone. Ils ont des masses atomiques différentes de celle qui est présentée dans le tableau périodique. Il en est de même pour la plupart des éléments. Des isotopes, ce sont donc des éléments qui ont le même nombre de protons, mais un nombre différent de neutrons dans leur noyau. Ainsi, leur masse diffère, mais leur nature et leur réactivité chimique est exactement la même. Ils ont le même symbole, le même numéro atomique (nombre Z), mais comme le nombre de neutrons est différent, ils n'ont pas le même nombre de masse (nombre A).
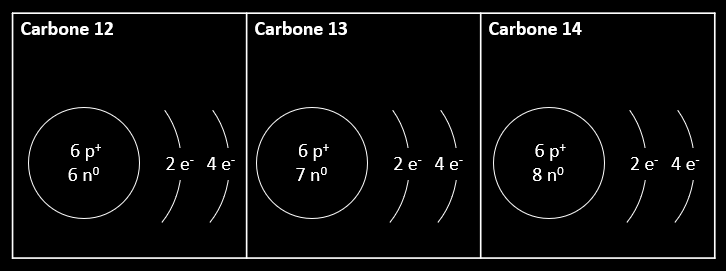
Les nucléons, ce sont les particules qui se retrouvent dans le noyau atomique. C'est le nombre de nucléons (somme des protons et des neutrons) que l'on utilise pour désigner un isotope. Ainsi, le carbone 12 possède 12 nucléons. Comme 6 d'entre eux sont des protons, on peut déduire qu'il possède 6 neutrons. Le carbone 14 a quant à lui 8 neutrons. Ce nombre est appelé nombre de masse d'un isotope. On peut aussi désigner un isotope sous la forme \( {^{A}_{Z}X} \).
\( {^{12}_{6}C} \) |
\( {^{13}_{6}C} \) | \( {^{14}_{6}C} \) |
|---|
Pour obtenir le nombre de neutrons, on soustrait le numéro atomique (Z) du nombre de masse (A).
Dans le premier isotope,
si on effectue cette soustraction, on obtiendra 12 nucléons - 6 protons = 6 neutrons.
Dans le deuxième isotope,
si on effectue cette soustraction, on obtiendra 14 nucléons - 6
protons = 8 neutrons.
Comme ils ont le même nombre de protons, les
isotopes sont de même nature. Comme ils ont le même nombre d’électrons, ils ont
la même réactivité chimique. Qu’est-ce qui diffère entre deux isotopes ? La
vérité, c’est que la plupart du temps, ça ne change pas tant de choses, mis-à-part
le fait que l’un sera plus lourd que l’autre. Cependant, dans certains cas, l’isotope
est radioactif et, comme tu peux t'en douter, la différence devient
capitale.
Un isotope radioactif est composé d’un noyau
instable qui se brisera de façon spontanée (radioactivité naturelle) ou de
façon provoquée (radioactivité artificielle). Il est important de mentionner
que lorsqu’on parle d’un isotope au noyau instable, on entend par cela, un
noyau qui se désintègre en émettant des particules nucléaires ou des photons.
Cela survient avec un isotope dont le noyau a une force de répulsion de ses
protons qui est supérieure à la force nucléaire. En d’autres mots, les neutrons
sont incapables de conserver la stabilité du noyau et la force de répulsion
des protons fait éclater le noyau. Tu verras cette
notion plus en détails dans la station 2.
1.2 Vidéo récapitulative
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer2. Utilisation des isotopes
2.1 Utilité des isotopes
Les isotopes, notamment les isotopes radioactifs, ont plusieurs applications. Évidement, on pense tout de suite aux centrales nucléaires ou aux bombes atomiques lorsqu'on parle de radioactivité, mais leur utilisation est beaucoup plus large.
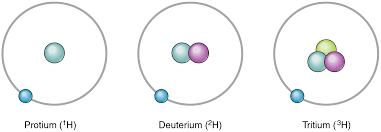
Voici un exemple : l’hydrogène peut être retrouvé dans les formes suivantes:
Ainsi, le protium, le deutérium et le tritium sont les différents isotopes de l’hydrogène.
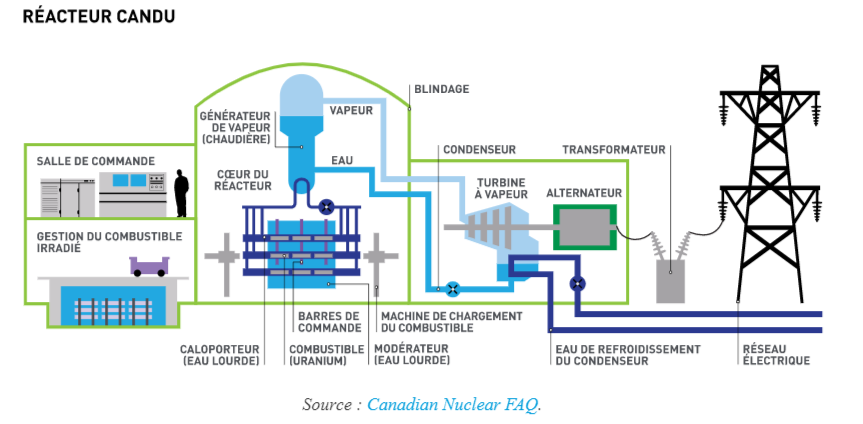
Le deutérium est aussi appelé hydrogène lourd. Lorsqu’il se combine à l’oxygène pour former de l’eau, on appelle cette eau de l’eau lourde. Celle-ci est entre autres utilisée dans les réacteurs nucléaires comme agent modérateur. Elle permet de ralentir les neutrons pour obtenir un meilleur contrôle de la réaction nucléaire. On retrouve cette technologie dans les réacteurs de type CANDU, développés ici même au Canada.
Présentement, 18 réacteurs CANDU sont en exploitation au Canada, soit 8 à Bruce Power, 6 à Pickering, 3 à Darlington et 1 à Point Lepreau. Pour en apprendre davantage sur les réacteurs CANDU du Canada, tu peux visiter le site de l’association nucléaire canadienne.
2.2 La radioactivité et la santé
En médecine, le nucléaire est partout. Outre la stérilisation des instruments, on s'en sert pour traiter certaines formes de cancer, pour évaluer la densité osseuse et on peut même s'en servir comme traceurs. Le principe du traceur est simple : on injecte un élément radioactif dans le corps et on étudie son déplacement dans le système circulatoire grâce au rayonnement qu'il émet. On peut ainsi détecter l'obstruction de vaisseaux sanguins ou le dysfonctionnement d'un organe.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer3. Définition de la masse atomique relative
3.1 Comment calculer la masse atomique relative
Jusqu'ici, on a vu que la masse d’un atome correspond à la masse des nucléons (soit les protons et les neutrons) et que le nombre de neutrons d’un élément se calcule en soustrayant le numéro atomique au nombre de masse. Pour ce faire, on doit arrondir le nombre de masse qu’on retrouve dans le tableau périodique puisqu’un nombre de particules ne peut être qu’un nombre entier. Cela nous amène donc à se demander la raison pour laquelle la masse inscrite dans le tableau n’est pas un nombre entier.
La masse atomique relative est la masse d’un atome déterminée par comparaison avec un élément de référence soit le carbone 12. Étant donné qu’un atome est très petit, il serait trop difficile et laborieux d’utiliser le gramme pour mesurer cette masse. Les scientifiques ont donc établi l’unité de masse atomique dont
le symbole est u ou u.m.a. (unité de masse atomique) pour représenter cette valeur. Par convention, cette unité de mesure correspond à 1/12 de la masse d’un atome de carbone.
Par exemple, si l’on compare la masse atomique de l’hydrogène (qui possède un nucléon) par rapport à la masse atomique du carbone 12 (qui possède 12 nucléons), on peut établir que l’hydrogène est environ12 fois plus léger que le carbone. Rappelons qu'un proton et un neutron ont sensiblement la même masse. Il faudrait donc 12 atomes d’hydrogène sur une balance pour équivaloir à 1 atome de carbone. Il est possible de dire que chaque atome d’hydrogène équivaut à 1u, soit 1/12 de la masse du carbone 12.

Ici, les billes rouges correspondent aux 12 atomes d’hydrogène et la bille noire correspond à l’atome de carbone.
3.2 Activité pour mieux comprendre la raison de la virgule
Dalton a écrit dans sa théorie sur l’atome que tous les atomes d’un même élément sont identiques. Les appareils modernes nous permettent de voir ce qui se passe à l’intérieur d’un atome. L'activité suivante permet d'observer les atomes d'un même élément pour voir s'ils sont identiques en tout point.
1 Observe la simulation suivante :
2 Clique sur l’onglet “mélange”.

3 Sélectionne “mélange de la nature”.
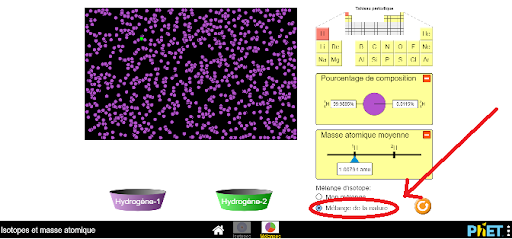
Comme on peut le constater, la grande majorité des points sur l’image sont mauves et un seul point est vert. Il y a donc deux types d’hydrogène sur Terre (l’hydrogène 1 et l’hydrogène 2) et le deuxième est très peu abondant. Dans l’encadré à droite de l’image, on retrouve différentes données relatives à cet élément.
4 Complète le tableau de données ci-dessous pour les 10 premiers éléments du tableau périodique. Ces données te seront utiles plus tard. Inspire-toi de l’exemple de l’hydrogène déjà complété dans le tableau. Tu peux changer d'élément en sélectionnant l'élément désiré dans le tableau périodique de l'application.
*N'oublie pas d'enregistrer lorsque tu auras terminé de compléter le tableau.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer4. Masse atomique relative
4.1 Comment calculer la masse atomique relative
Pour calculer la masse atomique relative présente dans le tableau périodique, il faut tenir compte de la masse de tous les isotopes de cet atome ainsi que de leur abondance relative respective. Comme on l'a vu dans l'expérience de la page précédente, les proportions des différents isotopes ne sont pas équivalentes. L'abondance relative, c'est la quantité d'atomes d'un isotope donné pour cent atomes de l'élément concerné. En tenant compte des abondances relatives, on obtiendra donc une sorte de moyenne des masses des isotopes.
Par exemple, le chlore 35 a une abondance relative de 75,77% et son isotope le chlore 37 a une abondance relative de 24,23%. Pour effectuer le calcul de la masse atomique relative, on multiplie le nombre de masse de chaque isotope par son abondance relative. Par la suite, on doit ensuite additionner chaque réponse obtenue.
Voici la façon de résoudre ce problème à partir des deux isotopes du chlore.
|
masse atomique relative = nombre de masse X abondance relative (%) chlore 35 x 75,77%= 2651,95 /100= 26,5195 u chlore 37 X 24,23%= 896,51/100= + 8,9651 u rép.: 35,4846 u ou u.m.a |
4.2 Vidéo récapitulative
NOTE : Cette vidéo comporte plusieurs sections. Pour passer d'une section à l'autre, appuie sur la bouton suivant en bas à droite mais choisis d'abord ton accompagnateur.
4.3 Quelques exercices
5. Synthèse
Astuce!
Tu veux réussir mieux ! Prends le temps de consigner dans le cahier de notes l'ensemble de tes apprentissages. Tu auras ainsi un cahier non seulement ordonné, mais aussi imprimable. De plus, le fait de résumer, d'expliquer, de synthétiser la matière te permet de mieux l'assimiler. Ton temps d'étude en sera sans aucun doute réduit!
Important : Lorsque tu prends des notes dans ton cahier, tu dois toujours cliquer sur "enregistrer" pour les conserver. Une fois tes notes compilées, n'oublie pas de cocher la boite à côté de cette ressource afin d'avoir accès au test de validation de la station.