M4S3_RE
| Site: | Moodle CSSRDN |
| Cours: | Science 4e secondaire (ST / STE) - 2023-2024 - Douance |
| Livre: | M4S3_RE |
| Imprimé par: | Visiteur anonyme |
| Date: | vendredi 16 janvier 2026, 13:47 |
Description
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
1. Oxydation (STE)
1.1 Oxydation rapide : le pouvoir du feu
L'oxydation est une transformation chimique dans laquelle le dioxygène (O2) ou tout autre substance ayant des propriétés semblables réagit avec une substance pour former de nouveaux produits.
1.2 Oxydation lente : Corrosion et dégradation
Les bananes noircissent, le toit du château Frontenac verdit et les clous deviennent oranges avec le temps. Les exemples d'oxydations lentes sont nombreux et variés.



1.3 Et les autres
L'oxygène n'est pas la seule substance qui est considérée comme étant un oxydant. Le dichlore (Cl2) ou le dibrome (Br2) peuvent être des oxydants par exemple. Certains êtres vivants vivent dans des milieux dits anaérobiques, c'est-à-dire des milieux qui n'ont pas d'oxygène. Comment ces êtres vivants respirent-ils ? Ils utilisent d'autres composés pour les substituer à l'oxygène. C'est d'ailleurs ce type de respiration qui cause l'odeur nauséabonde d'œuf pourri près de certains lacs. Les bactéries utilisent alors les composés de souffre comme agents oxydants.
1.4 Vidéo récapitulatif
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer2. Combustion
Qu'est-ce qu'un feu a besoin pour survivre ?
Pour survivre, un feu a besoin principalement de trois éléments. Si l'un de ces éléments manque, le feu ne survivra pas. Cependant, dès que les trois éléments sont présents, le feu peut se raviver. Un feu éteint n'est donc pas toujours parfaitement éteint. Il est important de toujours rester vigilant lorsqu'on joue avec le feu.
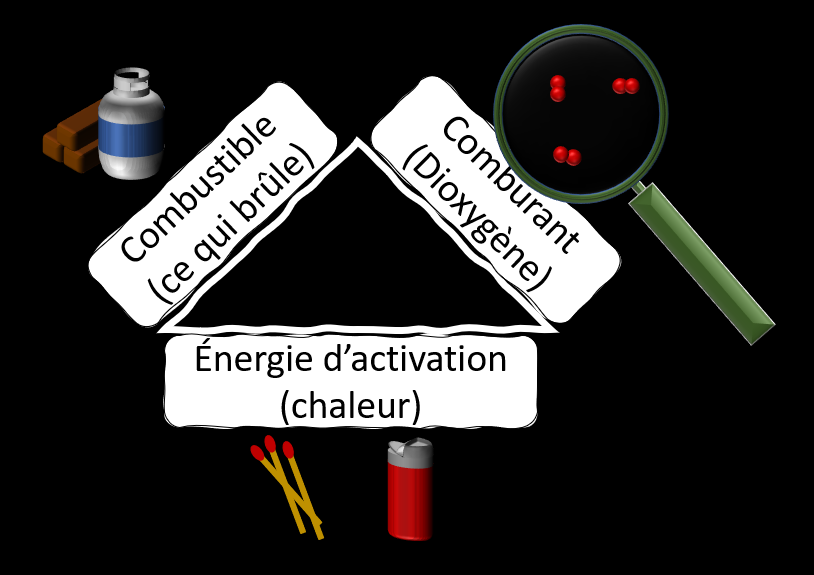
1 La chaleur
C'est bien connu, un feu, c'est chaud. Pourtant, si le feu produit une chaleur, il en a aussi besoin. La combustion est une réaction chimique qui nécessite une quantité d'énergie plus ou moins grande pour s'activer. Il n'est donc pas nécessaire d'avoir une flamme pour partir un feu, mais il faut une source de chaleur. La foudre, le feu d'une allumette, la chaleur d'un calorifère ou d'une cuisinière, un courant électrique d'un fil mal isolé, toute source de chaleur peut potentiellement amorcer un incendie. Si on prive le feu de cette source de chaleur, il s'éteindra.
2 Le combustible
3 Le comburant
Clique sur le bouton ci-dessous afin de poursuivre à la section suivantes.
Continuer2.1. Contrôler la chaleur
Tuer le feu par hypothermie
Je ne surprendrai personne en disant qu'il y a plus de feu de forêt l'été que l'hiver... du moins, au Québec. Lancer de la neige est un excellent moyen d'éteindre un feu dans un foyer extérieur. La neige absorbe la chaleur de la flamme pour fondre, puis pour s'évaporer. Privée de chaleur, la flamme meurt. C'est aussi ce qui éteint la bougie de votre gâteau d'anniversaire. Le souffle trop fort emporte avec lui la chaleur de la mèche.
Clique sur le bouton ci-dessous afin de poursuivre à la section suivante.
Continuer2.2. Contrôler le combustible
Affamer le feu
Si on dit qu'il n'y a pas de fumée sans feu, il n'y a pas de feu sans combustible. La meilleure façon de terminer une soirée autour d'un feu de camp est de laisser le feu mourir de sa belle mort. Évidement, il faut ensuite s'assurer d'éteindre les braises, mais en consommant l'ensemble du combustible, on se donne de meilleures chances d'éteindre le feu pour de bon. Aussi, avant d'allumer votre feu, assure-toi de dégager une espace raisonnable qui soit libre de feuilles mortes, de brindilles ou de sapinage. Assure-toi aussi que votre feu soit entouré de pierre. Ces bonnes pratiques pourraient t'éviter de bien mauvaises surprises.
Clique sur le lien ci-dessous afin de poursuivre à la section suivante.
Continuer2.3. Contrôler le comburant
Étouffer le feu
Comme nous l'avons vu, un feu a besoin du dioxygène contenu dans l'air pour brûler. Un feu de camp peut être éteint en l'enterrant de sable. On le prive ainsi d'air (donc d'oxygène). C'est aussi pourquoi on recommande d'emballer dans une grosse couverture un individu dont les vêtements sont en feu. C'est une façon efficace d'étouffer la flamme.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer3. Reconnaître une combustion
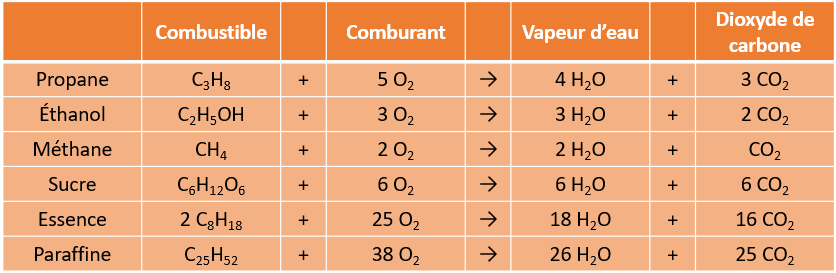
3. La combustion des composés organiques
Comme on l'a vu, un feu a besoin de trois éléments pour survivre, soit la chaleur, le combustible et le comburant (souvent de l'oxygène). Lorsque le combustible est un composé organique, que ce soit un hydrocarbure (substance composée de carbone et d'hydrogène tels que le propane ou le butane) ou une matière vivante comme le bois ou le sucre, celle-ci produira toujours les mêmes composés, soient de la vapeur d'eau et du dioxyde de carbone. Voici quelques exemples de réactions de combustion :
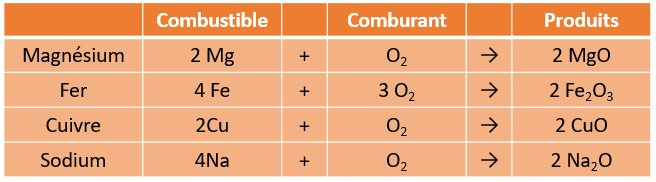
Pourtant, dans certains cas, on peut brûler d'autres substances, des métaux par exemple. Le cuivre produit une flamme d'une couleur distinctive. En effet, la combustion du cuivre produit une flamme verte.
clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer4. Une combustion
Brûler du sucre
On a vu au cours de la station précédente ce qu'est la réaction de combustion. Ainsi, pour la matière dite organique, le combustible et le comburant (le dioxygène) réagissent pour former du dioxyde de carbone et de la vapeur d'eau. Dans ce contexte, complète la réaction suivante :
clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer5. La respiration cellulaire
Donnez-moi de l'énergie !
Dans notre corps, la réaction globale de la combustion du sucre que l'on mange est la même. Autrement dit, notre alimentation procure le sucre, alors que notre respiration nous donne l'oxygène nécessaire à cette réaction. La respiration cellulaire est donc une réaction chimique qui est très semblable à une combustion. Elle est aussi une réaction vitale puisqu'elle nous fournit l'énergie nécessaire à notre survie. Évidement, on ne parle pas de flamme vive, mais c'est tout de même cette énergie, sous forme chimique, qui nous permet de garder notre chaleur, de bouger (volontairement ou non), de percevoir des stimuli de notre environnement ou de réfléchir et résoudre des problèmes.
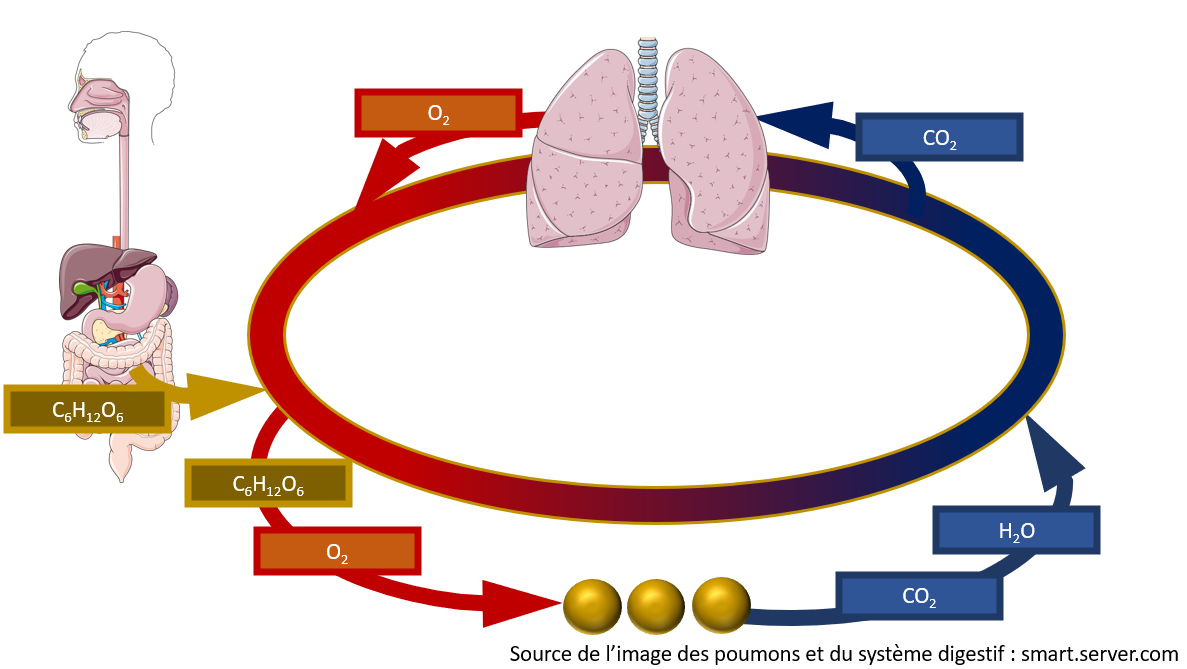
Mais attention ! Nous ne sommes pas les seuls à respirer ! Évidement, toute la vie animale repose sur la respiration cellulaire, et ce, même si certains organismes ont des modes de respiration un peu plus compliqués (spécialement ceux qui vivent en milieu anaérobique (sans oxygène)), mais il est important de savoir que les plantes aussi respirent. Ainsi, pour assurer leurs fonctions vitales, les végétaux aussi ont besoin de transformer leur sucre en énergie.

Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer6. La photosynthèse
Donnez-moi de l'oxygène !
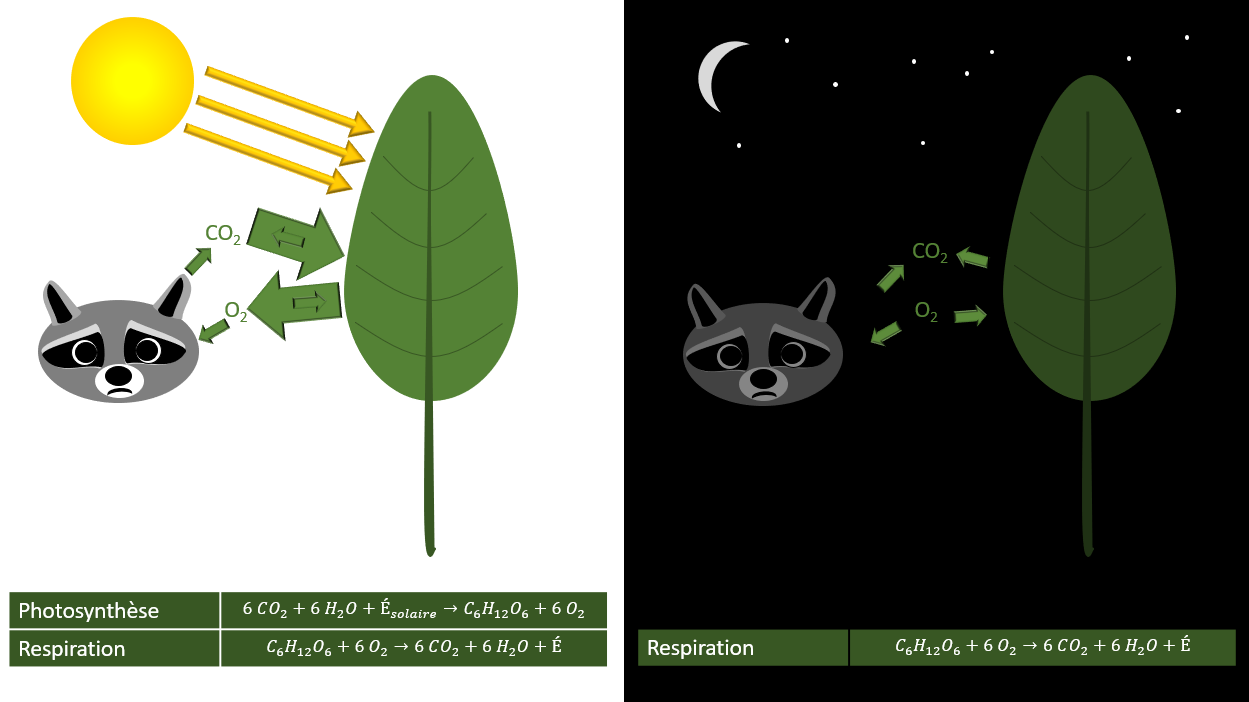
7. Synthèse
Astuce!
Tu veux réussir mieux ! Prends le temps de consigner dans le cahier de notes l'ensemble de tes apprentissages. Tu auras ainsi un cahier non seulement ordonné, mais aussi imprimable. De plus, le fait de résumer, d'expliquer, de synthétiser la matière te permet de mieux l'assimiler. Ton temps d'étude en sera sans aucun doute réduit!
Important : Lorsque tu prends des notes dans ton cahier, tu dois toujours cliquer sur "enregistrer" pour les conserver. Une fois tes notes compilées, n'oublie pas de cocher la boite à côté de cette ressource afin d'avoir accès au test de validation de la station.