M3S2_RE
| Site: | Moodle CSSRDN |
| Course: | Science 4e secondaire (ST / STE) - 2023-2024 - Douance |
| Book: | M3S2_RE |
| Printed by: | Visiteur anonyme |
| Date: | Friday, 16 January 2026, 7:49 PM |
Description
Tu dois parcourir l'ensemble des chapitres de ce cahier de ressources pour bien te préparer au test de validation de cette station.
Table of contents
- 1. Définitions
- 2. Concentration
- 3. Formule pour le calcul de la concentration en g/L
- 4. Les parties par million ou ppm
- 5. Les concentrations en pourcentages (% m/V, % m/m, % V/V)
- 6. Transformation des unités de mesure de la concentration
- 7. STE - La masse molaire (M) (rappel)
- 8. STE - La concentration molaire
- 9. Synthèse
1. Définitions
1.1 Qu'est-ce qu'une solution ?
Exemples de solutions liquides :
- Nettoyant à vitres
- Parfum
- Jus de raisin ou de pomme (filtré)
- Eau salée
L’air est un exemple de solution gazeuse
Contre-exemples
Les mélanges ci-dessous ne sont pas des solutions.
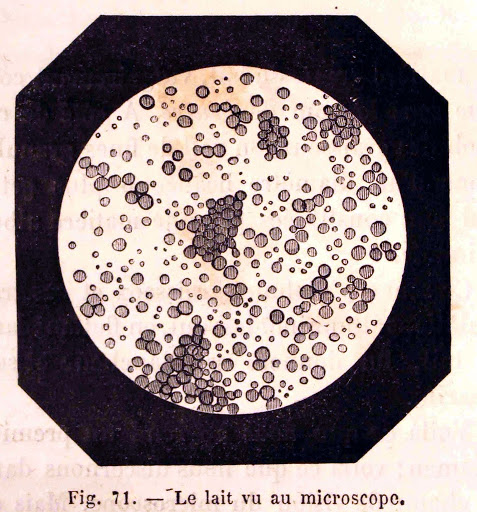
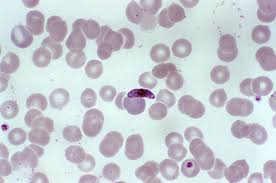
- Le lait et le sang ne sont pas transparents. Au microscope, on voit qu’ils contiennent de minuscules particules qui obstruent le passage de la lumière.
- Le jus d’orange n’est pas non plus transparent. À l’oeil nu, on peut voir des particules de pulpe en suspension.
- Un mélange d’huile et d’eau. Même si les deux liquides sont transparents, on peut facilement les distinguer à l’oeil nu car ils forment deux phases distinctes qui ne se mêlent pas.
- Le sable est composé de petites roches qu’on peut distinguer à l’oeil nu.
- La fumée n’est pas transparente. Elle est composée de gaz et de fines particules en suspension qui la rendent opaque.
1.2 Le solvant et le soluté
Un solvant est une substance d’une solution dans laquelle les autres composants sont dissous. Lorsque le solvant est de l’eau, on dit qu’il s’agit d’une solution aqueuse. Par exemple, l’eau de mer ou le jus de pomme sont des solutions aqueuses.
Un soluté est une substance d’une solution qui est dissoute dans le solvant. Dans une solution liquide, un soluté peut être solide, liquide ou gazeux.
Exemples :
- Sucre dissout dans une boisson fruitée (soluté solide)
- Alcool dissout dans un apéritif (soluté liquide)
- Oxygène dissout dans l’eau d’un lac (soluté gazeux)
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer2. Concentration
2.1 La définition de la concentration
La concentration permet de mesurer la quantité de soluté dissoute pour un certain volume de solution. La quantité de soluté peut être exprimée de plusieurs façons. On voit souvent sur les produits de consommation des concentrations en g/L ou en pourcentage (%).
Formule
\( Concentration = \frac{Quantité\ de\ soluté}{Volume\ de\ solution} \)
- Un échantillon d’eau de mer a une concentration en sel de 35 g/L, soit 35 grammes de sel pour un litre d’eau de mer.
- L'alcool médical est généralement utilisé dans le domaine de la santé comme désinfectant. Il est constitué de 70% v/v en éthanol. Ce qui équivaut à 70 mL d'éthanol pour 100 mL d'alcool médical.
Voici une vidéo explicative sur “Les concentrations” :
2.2 Un laboratoire virtuel !
Dans ce laboratoire, tu pourras étudier l'impact de différentes manipulations sur la concentration d'une solution.
Protocole
- Verser de l'eau dans le contenant jusqu'à ce que le volume soit de 500 ml (1/2L).
- Plonger l'appareil de mesure de concentration et noter la concentration initiale.
- Agiter la salière de soluté et observer l'impact de cet ajout sur la concentration de la solution.
- Ajouter de l'eau jusqu'à 1 L et observer l'impact de l'ajout de solvant sur la concentration de la solution.
- Rejeter environ 250 mL de solution avec le robinet de droite et observer l'impact sur la concentration de la solution.
- Activer l'évaporation jusqu'à ce le volume de la solution soit de 1/2 L et observer l'impact de l'évaporation sur la concentration de la solution.
- Saupoudrer du soluté jusqu'à ce qu'un dépôt se forme au fond du récipient. Observer l'indication de la Solution saturée. Ajouter encore un peu de soluté et observer l'impact de l'ajout de soluté sur la concentration d'une solution saturée.
3. Formule pour le calcul de la concentration en g/L
où
Exemple 1
Le sel d’Epsom est reconnu pour ses vertus relaxantes. Pour faire sa toilette du matin, Diane dissout 500 g de sel d’Epsom (MgSO4) dans son bain de 120 L. Quelle est la concentration de sel d’Epsom en g/L ?
Exemple 2
Il ne reste que 350 g de sel d’Epsom à Diane. Si elle veut toujours avoir une concentration de 4,17 g/L dans son bain du soir, quel devra être le volume de son bain ?
Ici, on connaît la masse (350 g) et la concentration (4,17 g/L). On cherche le volume (V).
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer4. Les parties par million ou ppm
Comme son nom l’indique, 1 ppm représente 1 millionième de la masse totale d’un mélange ou d’une solution. Ainsi, à une concentration de 1 ppm, on a 1 gramme de soluté pour 1 000 000 de grammes de mélange.
\( 1ppm= \frac{1g}{1000000g} = \frac{1g}{1000kg} = \frac{1mg}{1kg} \)
S’il s’agit d’une solution aqueuse, on peut convertir la masse de solution en mL parce que la masse volumique de l’eau est de 1 g/mL.
\( 1ppm= \frac{1g}{1000000mL} = \frac{1g}{1000L} = \frac{1mg}{1L} \)
Exemple 1
Sur l’étiquette d’une bouteille d’eau minérale, on lit que la teneur en sodium est de 300 ppm. Quelle masse de sodium contient la bouteille de 750 mL ?
300 ppm signifie qu’il y a 300 g de sodium pour 1 000 000 mL d’eau minérale. Nous recherchons la masse de sodium pour 750 mL.
\( \frac{300g}{1000000mL}= \frac{Xg}{750mL} \)
\( X= \frac{300g \times750mL }{1000000mL} =0,225g \)
La masse de sodium dans une bouteille de 750 mL est de 0,225 g ou 225 mgExemple 2
Un chimiste a mesuré 45 mg de mercure dans un échantillon de 900 g de sol. Quelle est la concentration de mercure en ppm ?
Nous avons la quantité pour 900 g, mais quelle serait-elle pour 1 000 000 de g ?
45 mg de mercure équivaut à 0,045 g
\( \frac{0,045g}{900g}= \frac{Xg}{1000000g} \)
\( X= \frac{0,02g \times1000000g }{900g} =50g \)
Il y aurait 50 g pour 1 000 000 g de sol. La concentration est donc de 50 ppm.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer5. Les concentrations en pourcentages (% m/V, % m/m, % V/V)
Concentrations en pourcentages
Si les ppm peuvent être comparés à des millionièmes d’un mélange, les pourcentages sont plutôt des centièmes d’un mélange ou d’une solution. Les lettres m et V nous indiquent si les unités du soluté et de la solution expriment une masse (g) ou un volume (mL).
- Le pourcentage masse/volume (% m/V) est..
la masse en g de soluté pour 100 mL de solution.
- Le pourcentage masse/masse (% m/m) est...
la masse en g de soluté pour 100 g de solution.
- Le pourcentage volume/volume (% V/V) est...
le volume en mL de soluté pour 100 mL de solution.
Exemple 1
Un contenant de 650 mL d’une boisson aux fruits contient 5,2 g de sucre. Quelle est la concentration en % m/V de sucre dans cette boisson ?
Pour trouver la concentration en % m/V, on doit trouver la masse en g contenue dans 100 mL de solution.
Nous savons qu’un volume de 650 mL contient une masse de 5,2 g.
Le produit des extrêmes est égal au produit des moyens.
Un volume de 100 mL contient 0,8 g de soluté. La concentration est donc de 0,8 % m/V.
Exemple 2
L’étiquette d’un apéritif alcoolisé indique que sa concentration en alcool est de 12 % V/V. Combien de mL d’alcool contient une bouteille de 0,5 L de cet apéritif ?
La concentration de 12 % V/V indique qu’un volume de 100 mL d’apéritif contient 12 mL d’alcool. On cherche le volume d’alcool lorsque le volume est de 0,5 L, soit 500 mL
Le produit des extrêmes est égal au produit des moyens.
La bouteille de 500mL contient 60 mL d’alcool.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer6. Transformation des unités de mesure de la concentration
Il existe une variété d’unités de mesure pour la concentration. Si on veut comparer la concentration de deux solutions, ou encore comparer une concentration à une norme, les deux mesures doivent avoir les même unités de mesure.
Cette vidéo présente un exemple de calcul de transformation d’unités.
Le tableau suivant, montré rapidement dans la vidéo, aide à définir et à comparer les différentes unités.
| Unité | Correspond à... |
|---|---|
| % m/v | |
| % v/v | |
| % m/m | |
| ppm |
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer7. STE - La masse molaire (M) (rappel)
Définition
C’est la masse en grammes d’une mole de particules (atomes ou molécules).
On obtient la masse molaire d’un atome en consultant le tableau périodique. Il suffit d’ajouter les unités “g/mol” à la valeur donnée pour la masse atomique
Exemple pour l’oxygène : la masse molaire de l’atome d’oxygène est de 16,00 g/mol
On obtient la masse molaire d’une molécule en additionnant les masses molaires de tous les atomes qui la composent.
8. STE - La concentration molaire
Définition et formule
La concentration molaire est exprimée en moles de soluté par litre de solution (mol/L).
Elle est plus significative lorsqu’on étudie les réactions chimiques. Par contre, elle est moins pratique lorsqu’on souhaite préparer une solution puisqu’on doit transformer les moles en grammes pour déterminer la masse de soluté à peser (consulter la section sur la Masse molaire).
Voici la formule pour effectuer le calcul de la concentration molaire
où
C est la concentration en mol/L ou M;
n est le nombre de moles de soluté (mol);
V est le volume de solution en L.
Regardes la vidéo ci-dessous pour en apprendre plus.
Exemple 1
Le glucose est une source d’énergie pour le corps humain. C’est la raison pour laquelle on utilise fréquemment des solutions aqueuses de glucose dans le domaine médical. On prépare 150 mL de solution de glucose en dissolvant
16,2 g de soluté ().
Quelle est la concentration molaire de cette solution ?
On doit d’abord trouver la quantité en mol qui correspond à 16,2 g de .
La masse d’une mole de glucose est de 180,16 g.
Le produit des extrêmes est égal au produit des moyens, il faut donc faire un produit croisé.
On peut maintenant calculer la concentration molaire.
Le volume de 150 mL doit être converti en litres (0,15 L).
La concentration en glucose de la solution est de 0,6 mol/L (ou 0,6 M).
Exemple 2
Certains aliments sont conservés dans une saumure, c’est-à-dire une solution aqueuse de sel de table (NaCl). On souhaite fabriquer 400 mL d’une solution de NaCl à 0,1 mol/L. Quelle masse de NaCl doit-on prévoir ?
Il faut d’abord déterminer le nombre de mol de NaCl nécessaire (n) avec la formule de la concentration.
Le volume de 400 mL doit être transformé en litres (0,4 L).
On convertit ensuite la quantité en mol obtenue en g.
La masse d’une mole de NaCl est de 58,44 g. Quelle est la masse de 0,04 mol ?
Le produit des extrêmes est égal au produit des moyens, il faut donc faire un produit croisé..
On doit prévoir 2,34 g de NaCl pour préparer cette solution.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer9. Synthèse
Astuce!
Tu veux réussir mieux ! Prends le temps de consigner dans le cahier de note l'ensemble de tes apprentissages. Tu auras ainsi un cahier non seulement ordonné, mais aussi imprimable. De plus, le fait de résumer, d'expliquer, de synthétiser la matière te permet de mieux l'assimiler. Ton temps d'étude en sera sans aucun doute réduit!
Important : Lorsque tu prends des notes dans ton cahier, tu dois toujours cliquer sur "enregistrer" pour les conserver. Une fois tes notes compilées, n'oublie pas de cocher la boite à côté de cette ressource afin d'avoir accès au test de validation de la station.