M3S4_RE
4. STE - Force des électrolytes
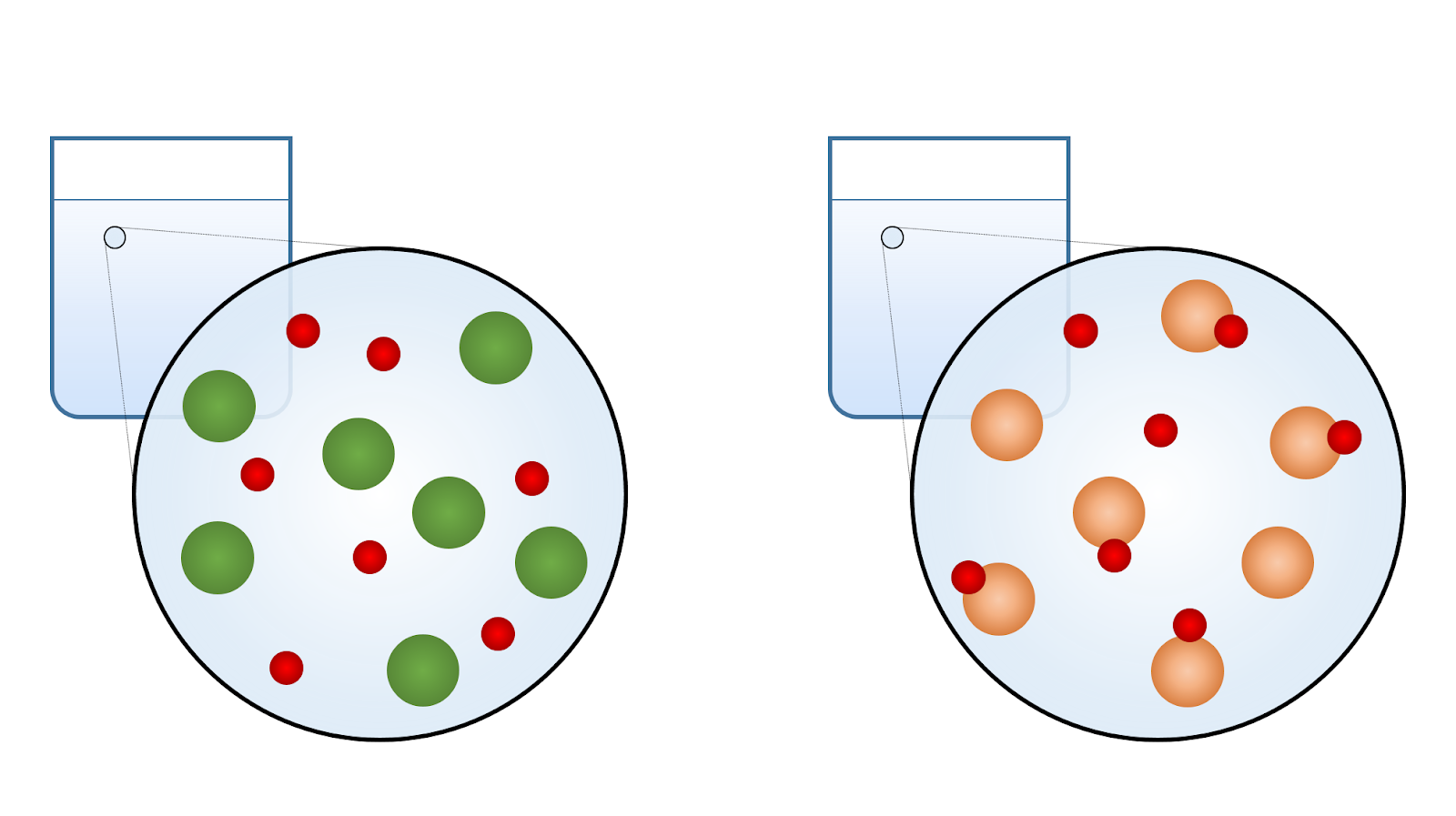
Des solutions acides ayant la même concentration molaire ont-elles la même conductibilité électrique ? Pas nécessairement… Essaie de trouver pourquoi à l’aide de cette simulation.
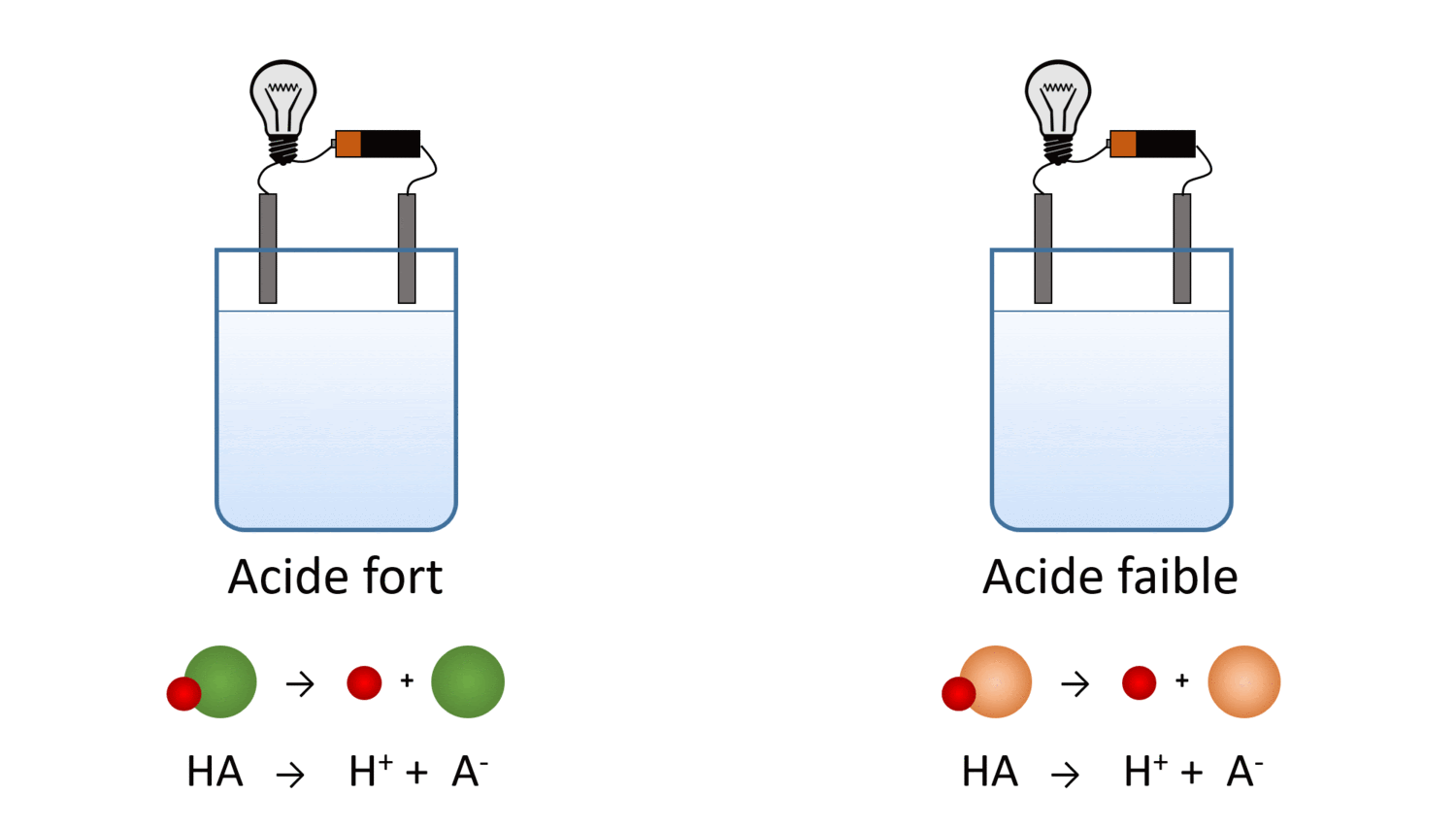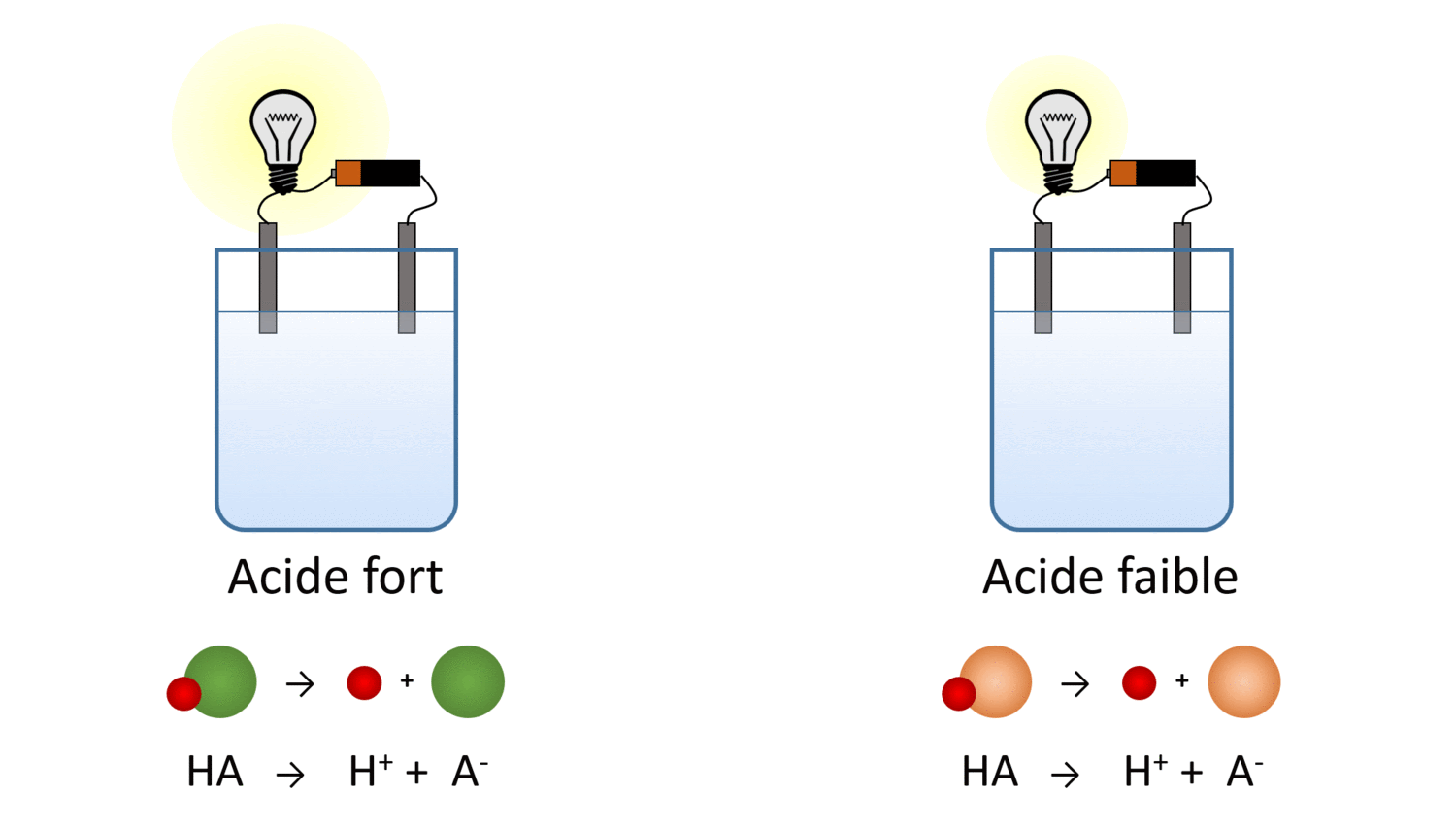
Va dans la portion “Introduction” de la simulation et sélectionne l’ampoule (dans la section Outil en bas à droite) pour mesurer la conductibilité électrique des cinq liquides. .
Dans cette simulation, les ions H3O + remplacent les ions H +
Le laboratoire virtuel t’a peut-être permis de tirer la conclusion suivante : malgré le fait que la quantité de molécules dissoutes est la même, les acides et les bases faibles produisent moins d’ions en solution. Leur conductibilité électrique en est réduite.
Un corollaire de cette conclusion est qu’il existe un lien entre la force d’un acide (ou d’une base) et son pH. Pour une même concentration molaire, l’acide faible libère moins d’ions H+ et a donc un pH plus grand, plus près de 7. Inversement, la base faible libère moins d’ions OH- et son pH est plus faible, aussi plus près de 7.