M2S2_RE
2. Liaisons ioniques
2.1 Des receveurs et des donneurs
On a vu dans la dernière section que ce sont les électrons de la dernière couche électronique qui interviendront dans les liaisons chimiques. Ainsi, certains atomes, principalement les métaux, auront une tendance naturelle à donner des électrons. D'autres atomes, principalement les non-métaux, auront une tendance naturelle à les recevoir. Tout ça, c'est une question d'électronégativité. Ainsi, lorsqu'un atome a une électronégativité beaucoup plus grande que l'autre, il se formera alors une liaison ionique. Logiquement, vous comprendrez que cette liaison unit généralement un métal à un non-métal. Le but est toujours de respecter la règle de l'octet et d'avoir la configuration électronique du gaz inerte le plus proche.
Examinons la liaison entre le magnésium et l'oxygène.
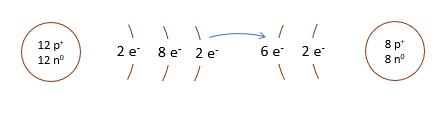
L'atome de magnésium contient 12 protons et 12 électrons. En observant la configuration électronique du magnésium, on remarque qu'il a 2 électrons sur sa dernière couche. Il est plus facile pour lui de perdre deux électrons que d'en gagner six afin que sa configuration électronique ressemble au néon, d'autant plus qu'étant à gauche du tableau, son électronégativité est faible.
L'atome de magnésium contient 12 protons et 12 électrons. En observant la configuration électronique du magnésium, on remarque qu'il a 2 électrons sur sa dernière couche. Il est plus facile pour lui de perdre deux électrons que d'en gagner six afin que sa configuration électronique ressemble au néon, d'autant plus qu'étant à gauche du tableau, son électronégativité est faible.
L'oxygène quant à lui a 8 électrons, dont six sont sur la dernière couche électronique. Comme il est à droite du tableau, on se doute bien que son électronégativité est élevée. C'est logique en fait puisque c'est sans doute plus facile pour l'oxygène de gagner deux électrons que d'en perdre six pour que sa configuration électronique ressemble au néon.
Ils forment donc un couple parfait.
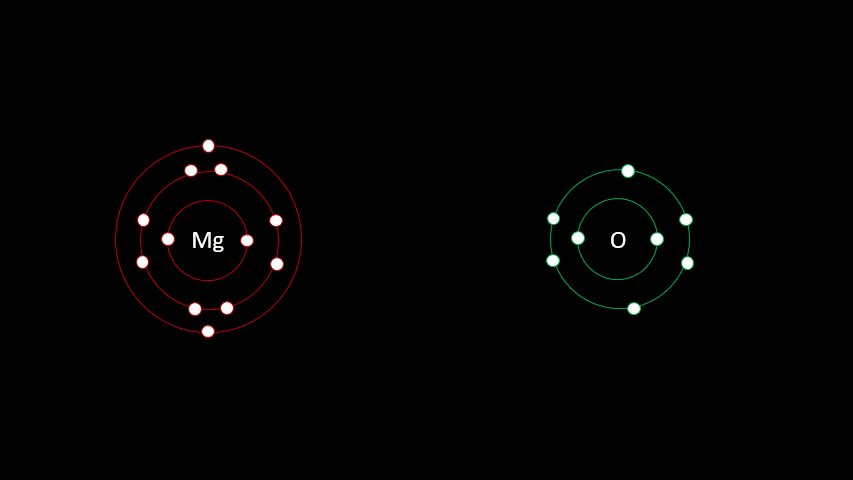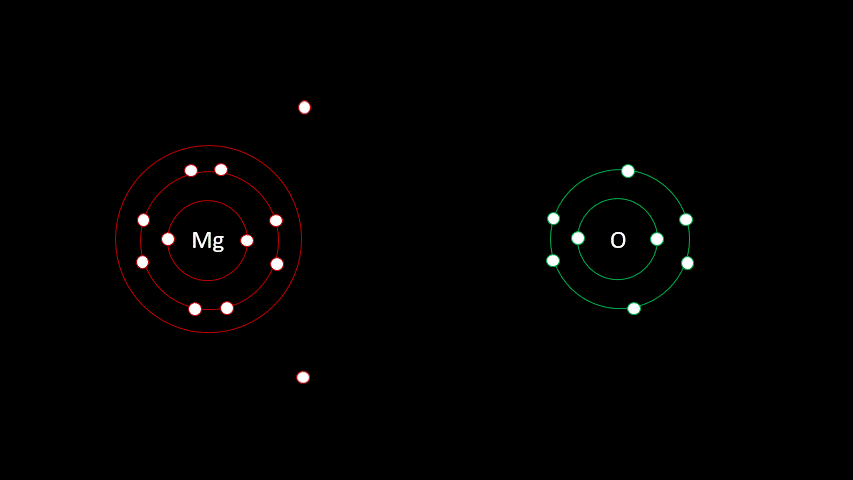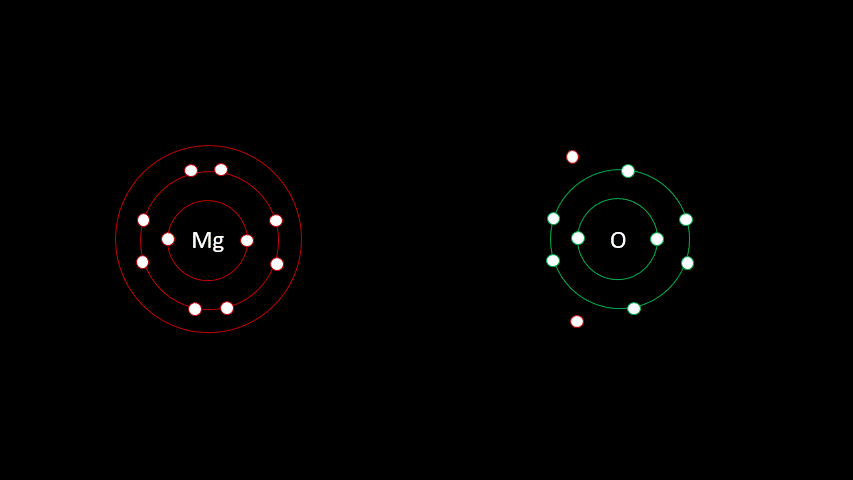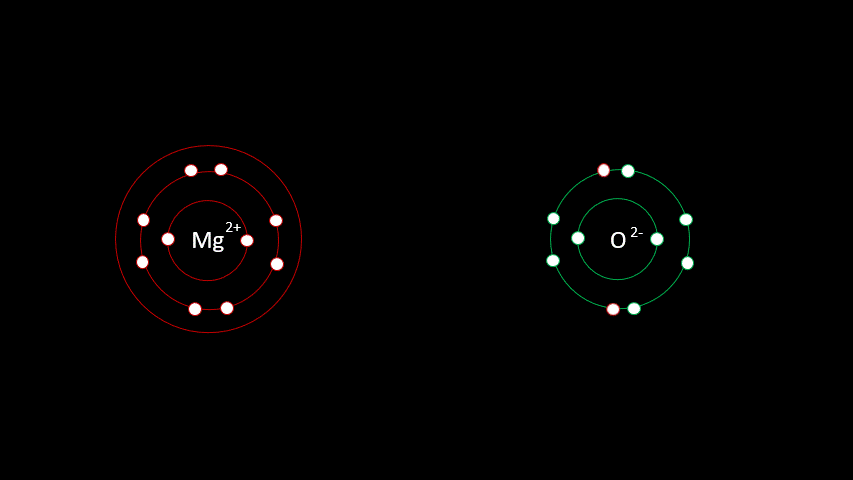
La vidéo suivante t'aidera à bien comprendre comment former des molécules ayant des liaisons atomiques du type ioniques.