M1S5_RE
2. La notation de Lewis
Lewis propose donc une représentation de l'atome qui ne tient compte que des électrons de valence. Cette notation sera essentielle lorsque nous expliquerons comment se forment les liaisons chimiques dans les molécules. Voici donc les grandes règles à suivre pour représenter un élément selon cette notation.
1. On place le symbole chimique de l'élément au centre. Imaginez autour de celui-ci 4 groupes situés aux quatre points cardinaux.
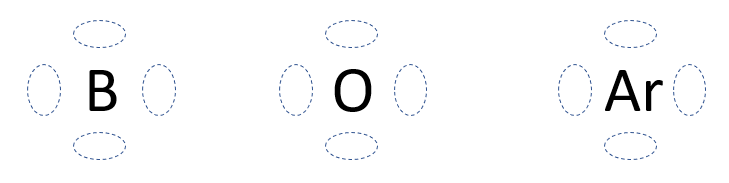
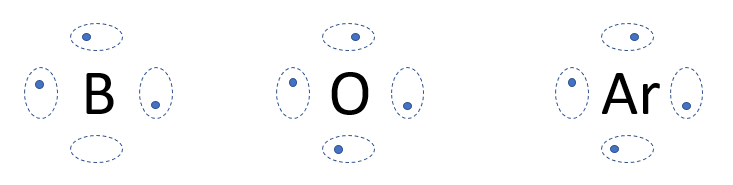
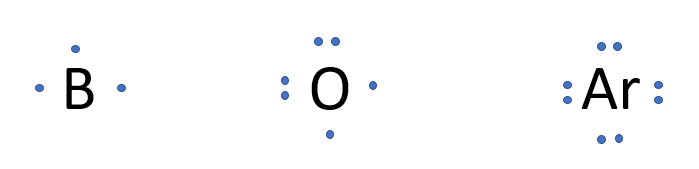

Gilbert N Lewis
Né en 1877 au Massachusetts et mort en 1946 à Berkeley en Californie, Gilbert Lewis a été nommé 41 fois pour le prix Nobel de chimie pour ses travaux en thermodynamique, mais ne l'a jamais obtenu. Il aurait été en mauvais termes avec un ancien collaborateur, Walther Nernst, qui était aussi membre du comité de chimie du prix Nobel. Il a entre autres étudié les acides et les bases et les liaisons chimiques dites de valence.