M1S3_RE
2. Les familles chimiques
2.1 Les caractéristiques
Chaque élément du tableau périodique possède des caractéristiques qui lui sont propres. Certaines propriétés chimiques sont dites quantitatives, c'est-à-dire qu'on peut leur accorder une valeur. C'est le cas de la température de fusion (solide vers liquide) et celle d'ébullition (liquide vers gaz) ou des conductibilités électrique et thermique. D'autres sont sont dites qualitatives (ne peuvent être quantifiées). C'est le cas de l'éclat, de la réactivité chimique, de la malléabilité ou de la ductilité. Vous avez vu au cours des années antérieures que certaines propriétés sont caractéristiques (masse volumique, température de fusion) alors que d'autres ne l'était pas (couleur, forme, état). Une propriété est dite caractéristique lorsqu'elle permet d'identifier un élément ou une famille d'éléments chimiques.
| Propriétés |
|---|
1. Conductibilité électrique 2. Conductibilité thermique 3. Malléabilité 4. Ductilité 5. Stabilité/réactivité chimique |
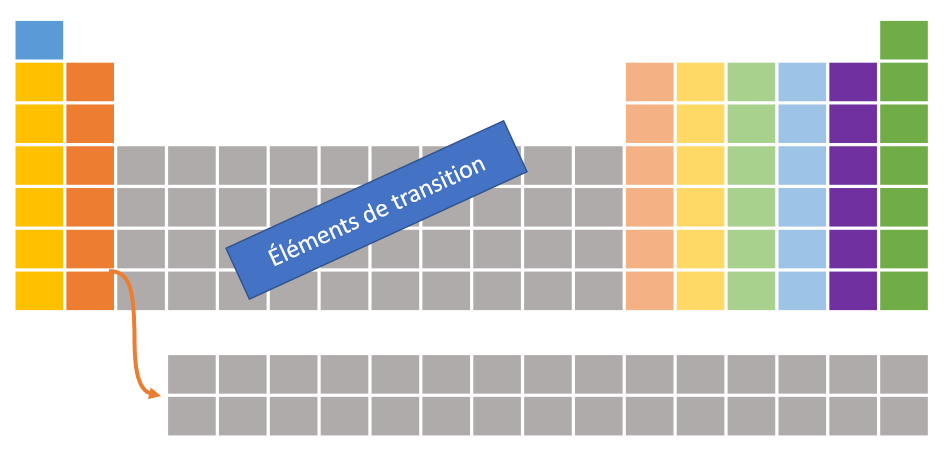
2.2 Les grandes familles
Les familles sont situées dans les colonnes du tableau périodique des éléments. Chaque famille partage les mêmes propriétés chimiques. C'est ce qui définit une famille. Dans le cadre de ce cours, nous étudierons seulement les familles mises en couleur dans l'image ci-dessous. En effet, nous n'étudierons pas les éléments de transition. Les numéros de famille iront donc de 1 à 8 en sautant par-dessus les éléments de transition. Il existe quatre grandes familles qui sont énumérées dans le tableau ci-dessous.
| Famille | Caractéristiques | Représentation |
|---|---|---|
| Alcalins Famille IA (1) | 1. Très bon conducteur électrique 2. Très bon conducteur thermique 3. Métal mou et malléable 4. Ductile 5. Très grande réactivité | 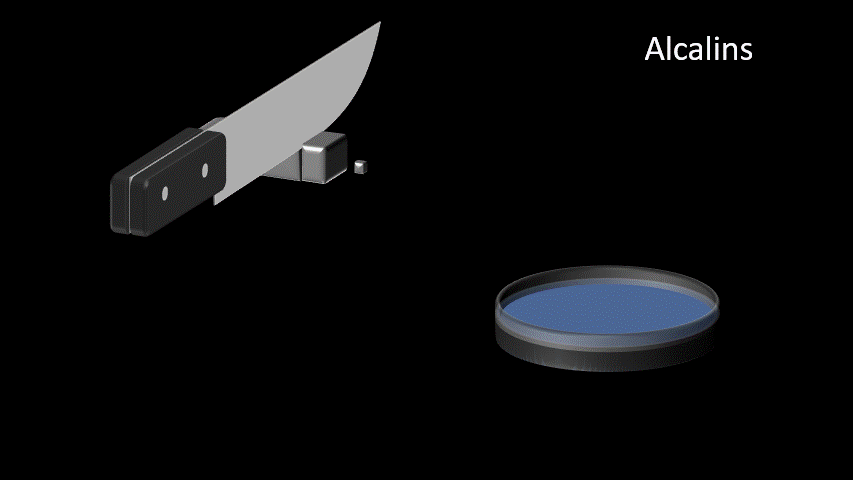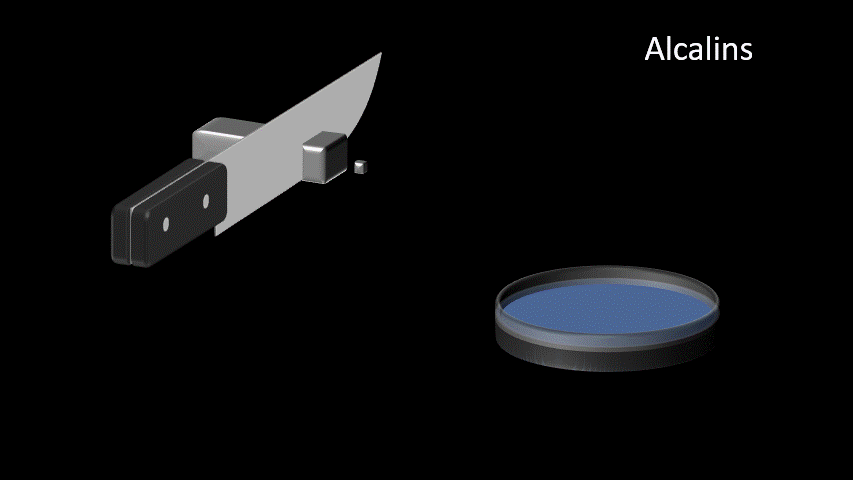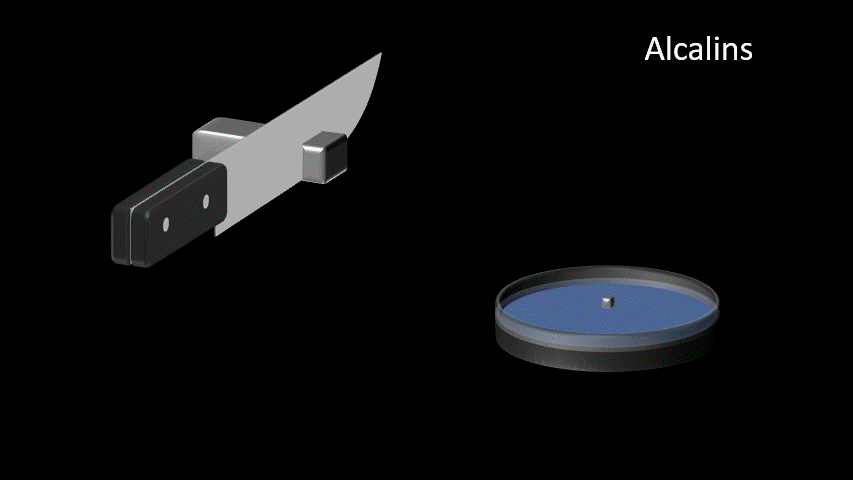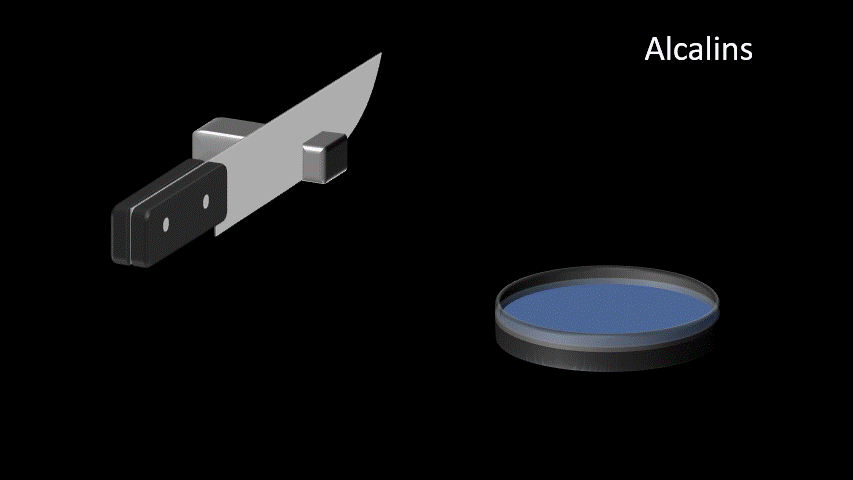 |
| Alcalino-terreux Famille IIA (2) | 1. Bon conducteur électrique 2. Bon conducteur thermique 3. Métal relativement mou et malléable 4. Ductile 5. Grande réactivité | |
| Halogènes Famille VIIA (7) | 1. Mauvais conducteur électrique 2. Mauvais conducteur thermique 3. Non-métal, non malléable 4. Non-ductile 5. Très grande réactivité | |
| Gaz inertes (gaz nobles) Famille VIIIA (8) | 1. Isolant électrique 2. Mauvais conducteur thermique 3. Non-métal, non malléable, gazeux 4. Non-ductile, gazeux 5. Très grande stabilité chimique |  |
Tu trouveras dans ce tableau périodique des éléments des images de chacun des éléments.
Pour les autres éléments du tableau périodique, on se réfère au premier élément de la famille. Par exemple, le sélénium (Se) fait partie de la famille de l'oxygène (O) et l'or (Au) fait partie de la famille du cuivre (Cu).
2.3 Explications
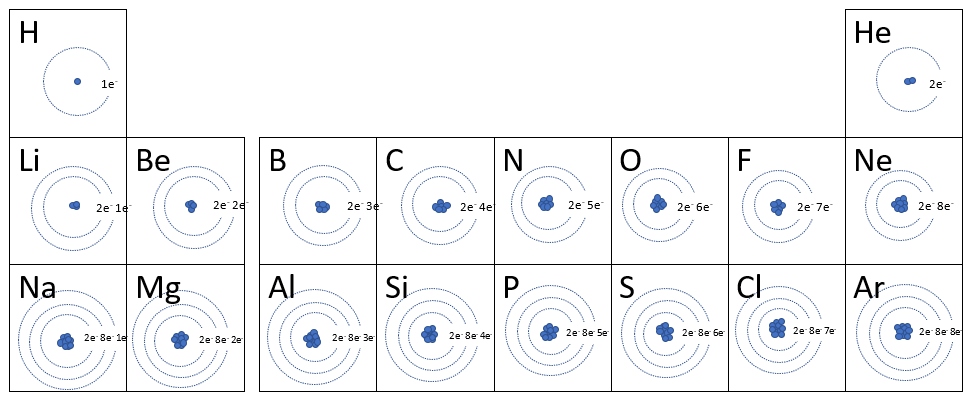
Dans la première station de ce module, il t'a été demandé d'étudier la représentation de la configuration électronique des 20 premiers éléments du tableau périodique. En voici un tableau :