M1S2_RE
3. Le modèle atomique simplifié
3.1 Les protons et la nature de l'atome
Pour aider à représenter un atome à l'exemple du modèle atomique simplifié, il faut d'abord savoir de quel atome on parle. La nature d'un élément, c'est-à-dire la sorte d'atome, comme l'oxygène ou le soufre par exemple, est déterminé par le nombre de proton qu'il possède. Par exemple, l'oxygène à 8 protons, l'hydrogène en un seul et l'uranium en a 92. On peut retrouver le nombre de protons que possède un atome en consultant son numéro atomique qu'on retrouve dans le tableau périodique des éléments.
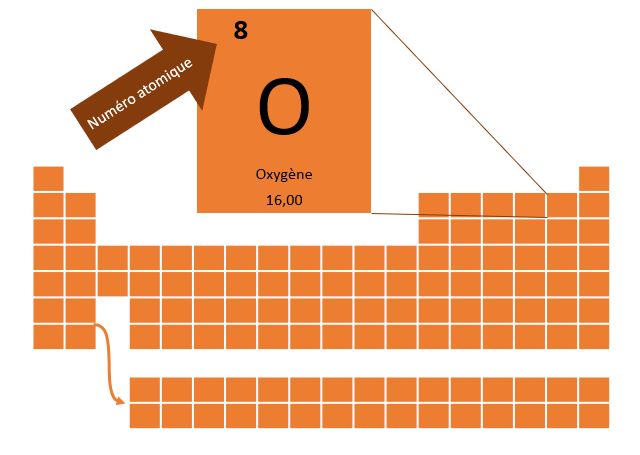
3.2 Les neutrons et la masse atomique
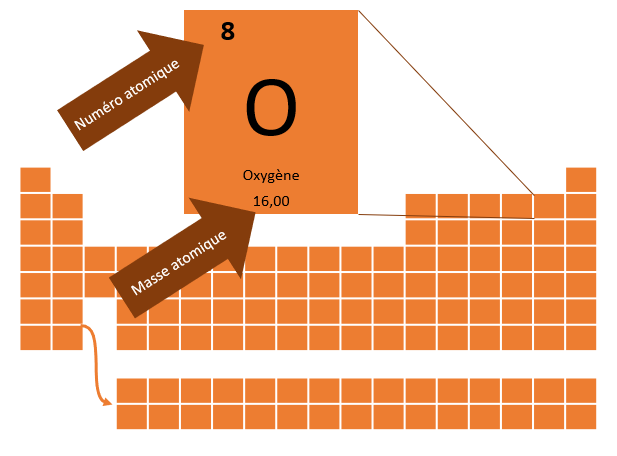
Le second nombre inscrit dans le tableau périodique est la masse atomique. Elle correspond au nombre de nucléons (particules dans le noyau de l'atome), puisque la masse de l'électron est négligeable par rapport à la masse totale de l'atome. Ce serait comme parler de l'influence de la masse d'un cheveu sur votre masse totale. Se raser la tête avant de monter sur la balance ne changera pas vraiment la masse affichée.
La masse atomique est exprimée en unités atomiques. Comme on peut s'en douter, la masse d'un atome est infiniment petite et le gramme serait une unité trop grande pour cette mesure. Ce serait comme si on mesurait le rayon d'une mine de crayon en kilomètres. 1 unité atomique correspond à 9,11 x 10 -31 kg.
Formule
Nombre de neutrons = Masse atomique - Numéro atomique
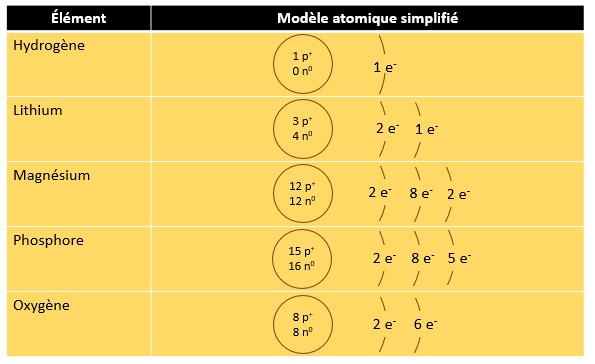
Dans le cas de l'oxygène, il y a donc 8 neutrons (16 - 8 = 8). Attention ! S'il est vrai que pour les éléments les plus légers, le nombre de protons et le nombre de neutrons sont parfois identiques, ce n'est pas toujours le cas. Le lithium (Li) par exemple a 3 protons et 4 neutrons.
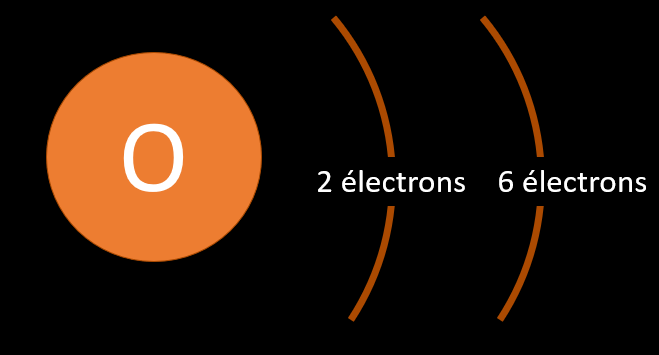
3.3 Les électrons et les canapés électroniques
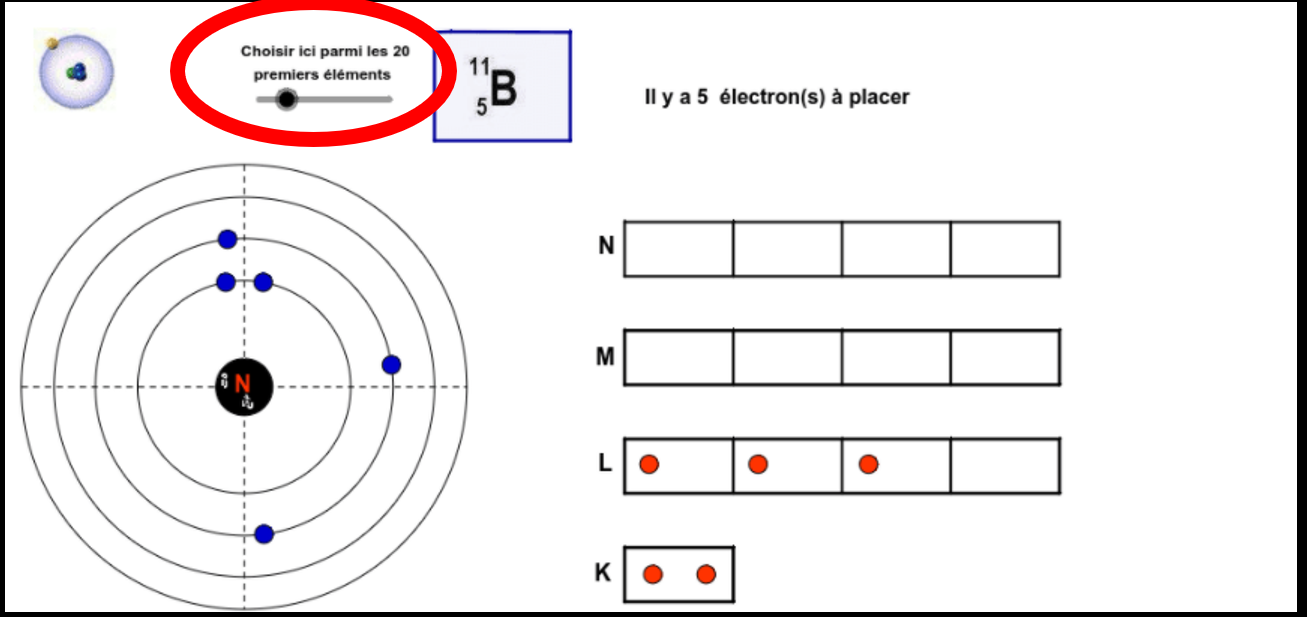
Configuration électronique des 20 premiers éléments
3.4 Le modèle atomique simplifié

3.5 Petit récapitulatif vidéo
Tu peux sélectionner ton accompagnateur en cliquant sur les photos au bas de l'image. Cette vidéo comporte plusieurs sections. Tu pourras naviguer entre les sections avec les boutons de navigation au bas de la vidéo.
Clique sur le bouton ci-dessous afin de poursuivre au chapitre suivant.
Continuer