M5S1_RE
3. Définition de la masse atomique relative
3.1 Comment calculer la masse atomique relative
Jusqu'ici, on a vu que la masse d’un atome correspond à la masse des nucléons (soit les protons et les neutrons) et que le nombre de neutrons d’un élément se calcule en soustrayant le numéro atomique au nombre de masse. Pour ce faire, on doit arrondir le nombre de masse qu’on retrouve dans le tableau périodique puisqu’un nombre de particules ne peut être qu’un nombre entier. Cela nous amène donc à se demander la raison pour laquelle la masse inscrite dans le tableau n’est pas un nombre entier.
La masse atomique relative est la masse d’un atome déterminée par comparaison avec un élément de référence soit le carbone 12. Étant donné qu’un atome est très petit, il serait trop difficile et laborieux d’utiliser le gramme pour mesurer cette masse. Les scientifiques ont donc établi l’unité de masse atomique dont
le symbole est u ou u.m.a. (unité de masse atomique) pour représenter cette valeur. Par convention, cette unité de mesure correspond à 1/12 de la masse d’un atome de carbone.
Par exemple, si l’on compare la masse atomique de l’hydrogène (qui possède un nucléon) par rapport à la masse atomique du carbone 12 (qui possède 12 nucléons), on peut établir que l’hydrogène est environ12 fois plus léger que le carbone. Rappelons qu'un proton et un neutron ont sensiblement la même masse. Il faudrait donc 12 atomes d’hydrogène sur une balance pour équivaloir à 1 atome de carbone. Il est possible de dire que chaque atome d’hydrogène équivaut à 1u, soit 1/12 de la masse du carbone 12.

Ici, les billes rouges correspondent aux 12 atomes d’hydrogène et la bille noire correspond à l’atome de carbone.
3.2 Activité pour mieux comprendre la raison de la virgule
Dalton a écrit dans sa théorie sur l’atome que tous les atomes d’un même élément sont identiques. Les appareils modernes nous permettent de voir ce qui se passe à l’intérieur d’un atome. L'activité suivante permet d'observer les atomes d'un même élément pour voir s'ils sont identiques en tout point.
1 Observe la simulation suivante :
2 Clique sur l’onglet “mélange”.

3 Sélectionne “mélange de la nature”.
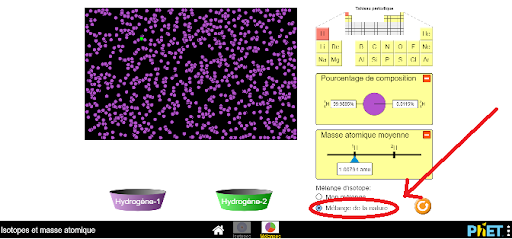
Comme on peut le constater, la grande majorité des points sur l’image sont mauves et un seul point est vert. Il y a donc deux types d’hydrogène sur Terre (l’hydrogène 1 et l’hydrogène 2) et le deuxième est très peu abondant. Dans l’encadré à droite de l’image, on retrouve différentes données relatives à cet élément.
4 Complète le tableau de données ci-dessous pour les 10 premiers éléments du tableau périodique. Ces données te seront utiles plus tard. Inspire-toi de l’exemple de l’hydrogène déjà complété dans le tableau. Tu peux changer d'élément en sélectionnant l'élément désiré dans le tableau périodique de l'application.
*N'oublie pas d'enregistrer lorsque tu auras terminé de compléter le tableau.